Hvad er Lewis -strukturen for ammoniumchlorid?
Lewis -struktur for ammoniumion (NH₄⁺)
1. nitrogen (n): Nitrogen har 5 valenselektroner.
2. brint (H): Hvert brint har 1 valenselektron.
3. Samlede valenselektroner: 5 (n) + 4 (1) (h) =9. Da det er en kation med en +1 ladning, trækker vi en elektron:9 - 1 =8.
4. placering: Kvælstof er det centrale atom, og de fire hydrogenatomer omgiver det.
5. obligationer: Hvert hydrogenatom danner en enkelt kovalent binding med nitrogen ved anvendelse af 8 elektroner i alt (4 bindinger x 2 elektroner/binding =8).
6. Formelle afgifter: Nitrogen har en formel ladning på +1, og hvert brint har en formel ladning på 0.
Lewis -struktur for chloridion (CL⁻)
1. klor (CL): Klor har 7 valenselektroner.
2. Samlede valenselektroner: 7. Da det er en anion med en -1 -ladning, tilføjer vi en elektron:7 + 1 =8.
3. placering: Klor er det centrale atom.
4. Elektroner: Chlor har 8 valenselektroner omkring det, repræsenteret som 4 par prikker.
5. Formelle afgifter: Klor har en formel afgift på -1.
repræsentation af ammoniumchlorid (NH₄CL):
Lewis -strukturer af NH₄⁺ og Cl⁻ kombineres for at repræsentere ammoniumchlorid. Den positive ladning på ammoniumion tiltrækker den negative ladning på chloridionen og danner en ionisk binding.
diagram:
[NH₄⁺] [cl⁻]
Nøglepunkter:
* Ammoniumchlorid er en ionisk forbindelse dannet af elektrostatisk tiltrækning mellem ammoniumioner (NH₄⁺) og chloridioner (CL⁻).
* De individuelle ioner Lewis -strukturer er vigtige for at forstå bindingen og strukturen af forbindelsen.
* Der er ingen enkelt Lewis -struktur for hele forbindelsen, da det er en ionisk forbindelse.
Husk, at Lewis -strukturen hjælper med at visualisere fordelingen af valenselektroner i et molekyle eller ion.
Sidste artikelHvad kalder du farven på pulver lavet af en klippe?
Næste artikelHvorfor er ammoniumchlorid et fast stof?
 Varme artikler
Varme artikler
-
 Forskere udvikler ny teori om molekylær evolutionForskere fra University of Colorado Anschutz Medical Campus og University College London har udviklet en ny teori om molekylær evolution, giver indsigt i, hvordan gener fungerer, hvordan hastighederne
Forskere udvikler ny teori om molekylær evolutionForskere fra University of Colorado Anschutz Medical Campus og University College London har udviklet en ny teori om molekylær evolution, giver indsigt i, hvordan gener fungerer, hvordan hastighederne -
 Ledig dynamik på CO-dækkede Pt (111) elektroderKredit:CC0 Public Domain Platin er uden tvivl det vigtigste elektrokatalysator materiale, ikke kun fordi det er den bedste enkeltelementkatalysator i en række vigtige elektrokatalytiske reaktioner
Ledig dynamik på CO-dækkede Pt (111) elektroderKredit:CC0 Public Domain Platin er uden tvivl det vigtigste elektrokatalysator materiale, ikke kun fordi det er den bedste enkeltelementkatalysator i en række vigtige elektrokatalytiske reaktioner -
 Omdannelse af atmosfærisk kulstof til industrielt anvendelige materialerKredit: RSC Advances (2021). DOI:10.1039/d1ra00954k Planter er uden sidestykke i deres evne til at fange CO 2 fra luften, men denne fordel er midlertidig, som restafgrøder frigiver kulstof tilb
Omdannelse af atmosfærisk kulstof til industrielt anvendelige materialerKredit: RSC Advances (2021). DOI:10.1039/d1ra00954k Planter er uden sidestykke i deres evne til at fange CO 2 fra luften, men denne fordel er midlertidig, som restafgrøder frigiver kulstof tilb -
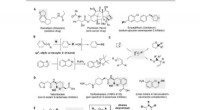 Borindsættelse i alkyletherbindinger via zink/nikkel -tandemkatalyseFunktionalisering af etherbindinger. (A) Småmolekylære lægemidler indeholdende cykliske ethergrupper. Ph, phenyl; Ac, acetyl; Bz, benzoyl; glu, glukose. (B) Overgangsmetal -katalyseret C -O -spaltning
Borindsættelse i alkyletherbindinger via zink/nikkel -tandemkatalyseFunktionalisering af etherbindinger. (A) Småmolekylære lægemidler indeholdende cykliske ethergrupper. Ph, phenyl; Ac, acetyl; Bz, benzoyl; glu, glukose. (B) Overgangsmetal -katalyseret C -O -spaltning


