Hvordan ved du, at en binding mellem magnesium og klor vil være ionisk?
* Elektronegativitetsforskel: Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner i en binding. Jo større elektronegativitetsforskellen mellem to atomer er, desto mere sandsynligt er det, at de danner en ionisk binding.
* Magnesium har en elektronegativitet på 1,31.
* Chlor har en elektronegativitet på 3,16.
Forskellen er 1,85, hvilket er en betydelig forskel.
* metal og ikke -metal: Magnesium er et metal, og klor er en ikke -metal. Metaller har en tendens til at miste elektroner (bliver kationer), og ikke -metaller har en tendens til at få elektroner (bliver anioner). Denne forskel i elektrondelingsadfærd favoriserer stærkt ionisk bindingsdannelse.
* Dannelse af ioner: Når magnesium og klor reagerer, mister magnesium to elektroner for at blive en +2 ion (mg²⁺). Klor får en elektron til at blive en -1 -ion (CL⁻). Disse modsatte ladede ioner tiltrækker stærkt og danner en ionisk binding.
Resultatet: Den stærke attraktion mellem den positivt ladede magnesiumion (mg²⁺) og de negativt ladede chloridioner (CL⁻) skaber en stabil ionisk forbindelse, magnesiumchlorid (MGCL₂).
 Varme artikler
Varme artikler
-
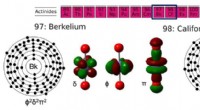 Meget tunge elementer leverer flere elektronerForskere viser, at berkelium og californium, yderligere to elementer i actinid -serien (elementer 89 til 103), har en overraskende stabil +5 oxidationstilstand. De farverige centrale billeder illustre
Meget tunge elementer leverer flere elektronerForskere viser, at berkelium og californium, yderligere to elementer i actinid -serien (elementer 89 til 103), har en overraskende stabil +5 oxidationstilstand. De farverige centrale billeder illustre -
 Glow-in-the-mørke papir som en hurtig test for infektionssygdommeDenne papirstrimmel (ekstremt zoomet ind) indeholder to kopier af testen. De tre lysende prikker pr. test indikerer, at du kan kontrollere tre forskellige antistoffer inden for en test. Kredit:Bart va
Glow-in-the-mørke papir som en hurtig test for infektionssygdommeDenne papirstrimmel (ekstremt zoomet ind) indeholder to kopier af testen. De tre lysende prikker pr. test indikerer, at du kan kontrollere tre forskellige antistoffer inden for en test. Kredit:Bart va -
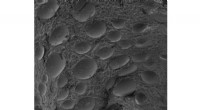 Ny polymer tackler PFAS -forureningForstørret visning af pulveriseret aktiveret kulpolymer, der binder sig til vandbåret PFAS, gør det muligt at fjerne det fra miljøet. Kredit:Flinders University Problemet med oprydning af giftige
Ny polymer tackler PFAS -forureningForstørret visning af pulveriseret aktiveret kulpolymer, der binder sig til vandbåret PFAS, gør det muligt at fjerne det fra miljøet. Kredit:Flinders University Problemet med oprydning af giftige -
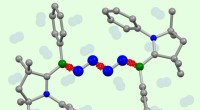 Inert nitrogen tvunget til at reagere med sig selvFor første gang, to molekyler af atmosfærisk nitrogen (blå, midten) er koblet direkte til hinanden i forskning af kemikere fra Würzburg og Frankfurt. Kredit:Dr. Rian Dewhurst / Dr. Marc-André Légaré
Inert nitrogen tvunget til at reagere med sig selvFor første gang, to molekyler af atmosfærisk nitrogen (blå, midten) er koblet direkte til hinanden i forskning af kemikere fra Würzburg og Frankfurt. Kredit:Dr. Rian Dewhurst / Dr. Marc-André Légaré
- SmokeBot – en robot, der betjener redningsenheder
- Forskere udvikler en optisk lineal, der kan måle ned til nanoskalaen
- Hvad er to typer fejl, der kan resultere i bjerge?
- Sony opgraderer helårsprognosen, logger hurtigt kvartalsresultat
- NASA ser den tropiske storm Flossie på vej til det centrale Stillehav
- Sult er stigende på verdensplan, men kvinder bærer hovedparten af fødevareusikkerhed


