Hvordan placeres elektroner i en orbitalskal?
1. Energiniveau og skaller:
* Energiniveau: Elektroner findes i specifikke energiniveauer omkring kernen. Disse niveauer er betegnet med det vigtigste kvantetal (N), som kan være ethvert positivt heltal (1, 2, 3 osv.). Højere tal indikerer højere energiniveau.
* skaller: Hvert energiniveau svarer til en elektronskal. Den første skal (n =1) er tættest på kernen, og efterfølgende skaller er længere væk.
2. Underskaller og orbitaler:
* underskaller: Hver elektronskal er opdelt i underskaller, betegnet med bogstaver (S, P, D, F).
* s-subshell: Indeholder kun en orbital, som kan indeholde op til 2 elektroner.
* p-subshell: Indeholder tre orbitaler, der hver holder op til 2 elektroner (i alt 6 elektroner).
* d-subshell: Indeholder fem orbitaler, der hver holder op til 2 elektroner (i alt 10 elektroner).
* f-subshell: Indeholder syv orbitaler, der hver holder op til 2 elektroner (i alt 14 elektroner).
* orbitaler: Hvert underskal er sammensat af en eller flere atomiske orbitaler, som er regioner i rummet, hvor der er stor sandsynlighed for at finde et elektron.
3. Påfyldningsordre og Hunds regel:
* aufbau -princip: Elektroner udfylder orbitaler, der starter fra det laveste energiniveau og bevæger sig op.
* Pauli Ekskluderingsprincip: Hver orbital kan maksimalt holde to elektroner, og disse elektroner skal have modsatte spins (repræsenteret som spin up ↑ og spin ned ↓).
* Hunds regel: Når der er fyldt orbitaler inden for et underskal, vil elektroner besætte hver orbital individuelt, før de parrer sig sammen i den samme orbital.
4. Elektronkonfiguration:
Elektronkonfigurationen af et atom beskriver fordelingen af elektroner i dens orbitaler. For eksempel er elektronkonfigurationen af ilt (O) 1S² 2S²2P⁴, hvilket betyder:
* 1S²: Den første skal (n =1) har 2 elektroner i S-subshellet.
* 2s²: Den anden skal (n =2) har 2 elektroner i S-subshellet.
* 2p⁴: Den anden skal (n =2) har 4 elektroner i p-subshellet (to orbitaler fyldt med en elektron hver og en orbital fyldt med to elektroner).
Eksempel:
Lad os overveje elementet nitrogen (N), der har 7 elektroner.
1. Energiniveau: De to første energiniveau (n =1 og n =2) er fyldt.
2. Underskaller: Den første skal har kun S-subshell (1s). Den anden skal har S- og P -underskaller (2s og 2p).
3. orbitaler: Subshell i 1S har en orbital, 2S -underskalet har en orbital, og 2P -underskalet har tre orbitaler.
4. Elektronkonfiguration:
* 1S²: 1'erne orbital er fyldt med 2 elektroner.
* 2s²: 2'erne orbital er fyldt med 2 elektroner.
* 2p³: 2P -orbitaler er fyldt med 3 elektroner. Hver af de tre 2p -orbitaler modtager en elektron (Hunds regel).
Derfor er elektronkonfigurationen af nitrogen 1S² 2S²2p³.
Kortfattet:
Placeringen af elektroner i orbitalskaller følger en bestemt rækkefølge baseret på energiniveau, underskaller, orbitaler og et par nøgleregler:Aufbau -princippet, Pauli -ekskluderingsprincippet og Hunds regel. Disse regler bestemmer elektronkonfigurationen af et atom, som er et grundlæggende aspekt af dets kemiske opførsel.
 Varme artikler
Varme artikler
-
 Nyt isoleringsmateriale giver en mere effektiv eldistributionKredit:Chalmers Tekniske Universitet Højspændings jævnstrømskabler, som effektivt kan transportere elektricitet over lange afstande, spiller en afgørende rolle i vores elforsyning. At optimere der
Nyt isoleringsmateriale giver en mere effektiv eldistributionKredit:Chalmers Tekniske Universitet Højspændings jævnstrømskabler, som effektivt kan transportere elektricitet over lange afstande, spiller en afgørende rolle i vores elforsyning. At optimere der -
 Tubulinhæmmer med en unik molekylær virkningsmekanismeFragmentvalg. A) Placering af stedet sID βαII (volumenrepræsentation) ved βTub1-αTub2 interdimer-grænsefladen af T2 R-TTL kompleks. For nemheds skyld er RB3- og TTL-kæderne ikke vist. De to α- og to
Tubulinhæmmer med en unik molekylær virkningsmekanismeFragmentvalg. A) Placering af stedet sID βαII (volumenrepræsentation) ved βTub1-αTub2 interdimer-grænsefladen af T2 R-TTL kompleks. For nemheds skyld er RB3- og TTL-kæderne ikke vist. De to α- og to -
 Forståelse af enzymkaskader er nøglen til forståelse af stofskifteLigesom myrer, et enzym følger sporet efterladt af det foregående. I dette tilfælde, det indledende substrat påvirkes af enzym A, efterlader et substrat, der er egnet til enzym B og på linjen. Kredit:
Forståelse af enzymkaskader er nøglen til forståelse af stofskifteLigesom myrer, et enzym følger sporet efterladt af det foregående. I dette tilfælde, det indledende substrat påvirkes af enzym A, efterlader et substrat, der er egnet til enzym B og på linjen. Kredit: -
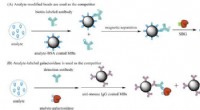 Ny immunoassay-teknik måler ekstremt lave koncentrationer af små molekyler ved hjælp af enkelt-mo…Skematisk illustration af konkurrerende Simoa-assays ved anvendelse af analytmodificerede MBer (A) og analyt-mærket β-galactosidase som konkurrent (B). Kredit:(c) Journal of the American Chemical Soc
Ny immunoassay-teknik måler ekstremt lave koncentrationer af små molekyler ved hjælp af enkelt-mo…Skematisk illustration af konkurrerende Simoa-assays ved anvendelse af analytmodificerede MBer (A) og analyt-mærket β-galactosidase som konkurrent (B). Kredit:(c) Journal of the American Chemical Soc
- Mørke stjerner:Mørkt stof kan danne eksploderende stjerner, og observation af skaden kan hjælpe m…
- Atom-tynd transistor bruger halvdelen af spændingen af almindelige halvledere, øger strømtæt…
- Hvad er gasserne på en komet?
- I hvilke områder vil jorddannelse være størst?
- Hvad er tilstanden af materie mantel?
- Sådan virker enzymer:UB-kemikere offentliggør en stor opdagelse


