Hvad er koncentrationen af chloridion i 229 ml opløsning, hvis tilsætning af overskydende sølvnitrat udfælder 8,07 g chlorid?
1. Forstå reaktionen
Sølvnitrat (Agno₃) reagerer med chloridioner (CL⁻) for at danne et hvidt bundfald af sølvchlorid (AgCl):
Agno₃ (aq) + cl⁻ (aq) → Agcl (s) + no₃⁻ (aq)
2. Beregn mol chlorid
* molmasse AGCL: 143,32 g/mol
* mol AgCl: (8,07 g AgCl) / (143,32 g / mol) =0,0563 mol AgCl
Da reaktionen er 1:1, er molen af chloridioner lig med molen af AgCl:0,0563 mol cl⁻
3. Beregn chloridkoncentration
* Løsningsvolumen: 229 ml =0,229 l
* Koncentration af chloridioner: (0,0563 mol cl⁻) / (0,229 l) = 0,246 m
Derfor er koncentrationen af chloridioner i 229 ml opløsning 0,246 m.
Sidste artikelHvilke af disse elementer er ikke en diatomisk nitrogenbromoxygencalcium?
Næste artikelHvor mange antal forbindelser er der?
 Varme artikler
Varme artikler
-
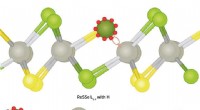 Defekter i nanopartikler hjælper med at drive produktionen af brint, et rent brændende brændsto…En rheniumbaseret nanopartikel indeholdende lige store mængder svovl og selen, mangler dog nogle svovlatomer (nederst til højre), vist sig at være den mest effektive elektrokatalysator. Kredit:America
Defekter i nanopartikler hjælper med at drive produktionen af brint, et rent brændende brændsto…En rheniumbaseret nanopartikel indeholdende lige store mængder svovl og selen, mangler dog nogle svovlatomer (nederst til højre), vist sig at være den mest effektive elektrokatalysator. Kredit:America -
 Sådan bliver en badesvamp til et biobaseret industrielt filterProfessor Hermann Ehrlich ser på et stykke af det nye materiale. Kredit:TU Bergakademie Freiberg / C. Mokry Forskere ved TU Bergakademie Freiberg udviklede et innovativt materiale fra en dyrket ma
Sådan bliver en badesvamp til et biobaseret industrielt filterProfessor Hermann Ehrlich ser på et stykke af det nye materiale. Kredit:TU Bergakademie Freiberg / C. Mokry Forskere ved TU Bergakademie Freiberg udviklede et innovativt materiale fra en dyrket ma -
 Modifikationer af ikke-fulleren små molekyle acceptor i organisk tynd film til solceller forbedrer …Kredit:Australian Synchrotron Forskere fra Imperial College London, Monash University, CSIRO, og King Abdullah University of Science and Technology har rapporteret om en organisk tynd film til sol
Modifikationer af ikke-fulleren små molekyle acceptor i organisk tynd film til solceller forbedrer …Kredit:Australian Synchrotron Forskere fra Imperial College London, Monash University, CSIRO, og King Abdullah University of Science and Technology har rapporteret om en organisk tynd film til sol -
 Forskere skaber 3D-printede, mikroskopiske gassensorer:Malerpaller uden et strejf af pigment3D-printet mikroskopisk gassensor. Midt:Foto af glassubstratet, der viser den farverige 3D-printede sensor. Venstre:Zoomede optiske mikroskopibilleder, der viser den pixelerede sensor som reaktion på
Forskere skaber 3D-printede, mikroskopiske gassensorer:Malerpaller uden et strejf af pigment3D-printet mikroskopisk gassensor. Midt:Foto af glassubstratet, der viser den farverige 3D-printede sensor. Venstre:Zoomede optiske mikroskopibilleder, der viser den pixelerede sensor som reaktion på
- Laserstråler reflekteret mellem Jorden og månen øger videnskaben
- Hvad er den vigtigste årsag til tektonisk pladebevægelse?
- Kan planeter forynges omkring døde stjerner?
- Cellebiolog udpeger, hvordan RNA-vira kopierer sig selv
- Forklaring på forskellen mellem viskositet og opdrift
- Sådan fungerer CO2 -skrubning


