Hvor mange nitrogenatomer er der i 7,5 g cano32?
1. Find den molære masse af Ca (no₃) ₂
* Calcium (CA):40,08 g/mol
* Nitrogen (N):14,01 g/mol (ganget med 2, fordi der er to nitrogenatomer)
* Oxygen (O):16,00 g/mol (ganget med 6, fordi der er seks iltatomer)
Total molmasse =40.08 + (14.01 * 2) + (16.00 * 6) =164,10 g/mol
2. Beregn molen af CA (NO₃) ₂
* Mol =masse / molær masse
* Mol =7,5 g / 164,10 g / mol ≈ 0,0457 mol
3. Beregn antallet af nitrogenatomer
* Hver mol Ca (NO₃) ₂ indeholder 2 mol nitrogenatomer.
* Samlet mol nitrogenatomer =0,0457 mol * 2 =0,0914 mol
* For at konvertere mol til antallet af atomer skal du bruge Avogadros nummer (6,022 x 10²³ atomer/mol):
* Antal nitrogenatomer =0,0914 mol * 6,022 x 10²³ atomer/mol ≈ 5,50 x 10² ² atomer
Derfor er der ca. 5,50 x 10²² nitrogenatomer i 7,5 g Ca (No₃) ₂.
Sidste artikelHvad er delen i kuldioxid?
Næste artikelHvad var Niels Bohrs bidrag til atomstruktur?
 Varme artikler
Varme artikler
-
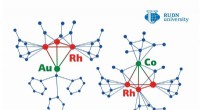 Kemikere foreslår en metode til fremstilling af metalbaserede katalysatorer med uovertruffen effekt…Kredit:RUDN Universitet Et team af kemikere fra RUDN University og Nesmeyanov Institute of Organoelement Compounds (INEOS) syntetiserede to heterometalliske klynger med næsten 100 % effektivitet.
Kemikere foreslår en metode til fremstilling af metalbaserede katalysatorer med uovertruffen effekt…Kredit:RUDN Universitet Et team af kemikere fra RUDN University og Nesmeyanov Institute of Organoelement Compounds (INEOS) syntetiserede to heterometalliske klynger med næsten 100 % effektivitet. -
 Nye elektroder kan øge effektiviteten af elektriske køretøjer og flyParaskevi Flouda holder prøve af ny elektrode. Kredit:Texas A&M Engineering Stigningen i popularitet af elektriske køretøjer og fly giver mulighed for at bevæge sig væk fra fossile brændstoffer mo
Nye elektroder kan øge effektiviteten af elektriske køretøjer og flyParaskevi Flouda holder prøve af ny elektrode. Kredit:Texas A&M Engineering Stigningen i popularitet af elektriske køretøjer og fly giver mulighed for at bevæge sig væk fra fossile brændstoffer mo -
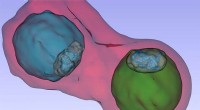 Malariapatogen under røntgenmikroskopetDetaljer såsom parasitternes vakuol (farvet i blåt og grønt) inde i en inficeret blodcelle. Kredit:S. Kapishnikov Malaria er en af de mest truende infektionssygdomme i verden. Et internationalt
Malariapatogen under røntgenmikroskopetDetaljer såsom parasitternes vakuol (farvet i blåt og grønt) inde i en inficeret blodcelle. Kredit:S. Kapishnikov Malaria er en af de mest truende infektionssygdomme i verden. Et internationalt -
 Hvad gør kobolt afgørende for livet?Kredit:Wikipedia Cobalt sidder i midten af corrinringen af vitamin B12 og de vigtige cobalaminer, vi får fra det. Måske overraskende er det kun to af vores enzymer, der gider bruge disse smerte
Hvad gør kobolt afgørende for livet?Kredit:Wikipedia Cobalt sidder i midten af corrinringen af vitamin B12 og de vigtige cobalaminer, vi får fra det. Måske overraskende er det kun to af vores enzymer, der gider bruge disse smerte
- Hvad er et andet navn Fot Dorsal?
- Uddybende spørgsmål:Er lektier dårligt for børn?
- Hvordan påvirker en stjernestørrelse sin farve og temperatur?
- Genovervej træernes indvirkning på vandkredsløb og klima, spørger videnskabsmænd
- Potentielle p-piller til mænd har sin oprindelse i en pilegift
- Hvad er et eksempel på ordnet kompleksitet?


