Hvorfor er anilin mindre grundlæggende end ammoniak?
Elektrondelokalisering og resonans
* anilin: Det ensomme par elektroner på nitrogenatomet i anilin kan deltage i resonans med benzenringen. Denne delokalisering spreder elektrondensiteten over hele ringen, hvilket gør det ensomme par mindre tilgængeligt til donation.
* ammoniak: Det ensomme par på nitrogenet i ammoniak er lokaliseret og let tilgængeligt til donation.
induktiv effekt
* Benzenringen i anilin har en let elektronisk tilbagetrækning induktiv effekt. Denne effekt trækker elektrondensitet væk fra nitrogenatomet, hvilket gør det mindre sandsynligt, at det accepterer en proton (H + ) og reducere dens grundlæggende.
Hybridisering
* anilin: Nitrogenatomet i anilin er sp 2 Hybridiseret, hvilket fører til et lidt mere elektronegativt nitrogen sammenlignet med sp 3 Hybridiseret nitrogen i ammoniak.
* ammoniak: Nitrogenatomet i ammoniak er sp 3 hybridiseret.
Kortfattet:
Kombinationen af resonans, induktiv virkning og hybridisering i anilin bidrager alle til at gøre det mindre grundlæggende end ammoniak.
Nøglepunkt: Grundlighed er et mål for, hvor let et molekyle accepterer en proton (h + ). Anilines reducerede elektrontilgængelighed på nitrogenet gør det mindre villig til at acceptere en proton sammenlignet med ammoniak.
Sidste artikelHvad kunne gå galt, når man eksperimenterer med saltsyre?
Næste artikelHvad er Coclo32 den kemiske formel til?
 Varme artikler
Varme artikler
-
 Forskere finder frustration i batterimaterialerKunstnergengivelse af det faste elektrolytmateriale, viser lithium-atomer (lilla) bevæger sig inden for en matrix af anioner sammensat af bor (grøn), kulstof (grå) og brint (hvid) atomer. Kredit:Joel
Forskere finder frustration i batterimaterialerKunstnergengivelse af det faste elektrolytmateriale, viser lithium-atomer (lilla) bevæger sig inden for en matrix af anioner sammensat af bor (grøn), kulstof (grå) og brint (hvid) atomer. Kredit:Joel -
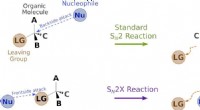 Udvikling af en fundamental reaktion i organisk kemi - opdagelse af en ny nukleofil substitutionsrea…Skema af lærebogen SN2 nukleofil substitutionsreaktion, og den nyopdagede SN2X-reaktion. Kredit:School of Physical and Mathematical Sciences, Nanyang Teknologiske Universitet Nukleofil substitutio
Udvikling af en fundamental reaktion i organisk kemi - opdagelse af en ny nukleofil substitutionsrea…Skema af lærebogen SN2 nukleofil substitutionsreaktion, og den nyopdagede SN2X-reaktion. Kredit:School of Physical and Mathematical Sciences, Nanyang Teknologiske Universitet Nukleofil substitutio -
 Elektronmikroskopi afslører årsagen til de lilla pletter på Alhambra-lofterneForgyldt blik på gips ved Alhambra-paladserne. (A) Generelt billede af Lions-paladset. (B) Polykrome forbliver udviser spor af lilla farve på begrænsede våde steder (sorte pile). (C) Beskadiget forgyl
Elektronmikroskopi afslører årsagen til de lilla pletter på Alhambra-lofterneForgyldt blik på gips ved Alhambra-paladserne. (A) Generelt billede af Lions-paladset. (B) Polykrome forbliver udviser spor af lilla farve på begrænsede våde steder (sorte pile). (C) Beskadiget forgyl -
 Tager Australiens hjemmedyrkede superfood mainstreamEt lupinfrø. Kredit:Edith Cowan University Lupiner har længe været udråbt som den næste superfood, bekæmpelse af hjertesygdomme, diabetes og fedme og ny forskning fra Edith Cowan University (ECU)
Tager Australiens hjemmedyrkede superfood mainstreamEt lupinfrø. Kredit:Edith Cowan University Lupiner har længe været udråbt som den næste superfood, bekæmpelse af hjertesygdomme, diabetes og fedme og ny forskning fra Edith Cowan University (ECU)
- Kunstig intelligens trænet til at analysere årsagssammenhæng
- Abba:Hvem kan egentlig lide dem?
- Dieselabetest:kan skadelig virksomhedsforskning nogensinde retfærdiggøres?
- AAFP udgiver ny, hvordan man fodrer en kat konsensuserklæring til veterinærsamfundet
- Formularer som varmt materiale stiger og koldt dræn?
- Team opfinder metode til at krympe objekter til nanoskalaen


