Hvad er valensen af svovl?
* Elektronisk konfiguration: Svovl har 6 valenselektroner (elektroner i sin yderste skal).
* octet regel: Svovl har en tendens til at vinde eller dele elektroner for at opnå en stabil oktet (8 elektroner) i sin ydre skal.
fælles valenser af svovl:
* +2: Svovl kan miste 2 elektroner og danne kationer som S²⁺ (findes i nogle sulfider).
* +4: Svovl kan miste 4 elektroner og danne kationer som S⁴⁺ (findes i nogle svovloxider).
* +6: Svovl kan miste 6 elektroner og danne kationer som S⁶⁺ (findes i nogle svovlforbindelser som svovlsyre).
* -2: Svovl kan vinde 2 elektroner og danne anioner som S²⁻ (findes i sulfider som natriumsulfid).
Eksempler:
* sulfider: I forbindelser som H₂s (hydrogensulfid) har svovl en valens på -2.
* svovldioxid (SO₂): Svovl har en valens på +4.
* svovltrioxid (SO₃): Svovl har en valens på +6.
* svovlsyre (h₂so₄): Svovl har en valens på +6.
Vigtig note: Valensen af svovl påvirkes af elektronegativiteten af de andre elementer, den binder med.
Sidste artikelHvad er valenselektroner i brint?
Næste artikelHvad er valensen af brint?
 Varme artikler
Varme artikler
-
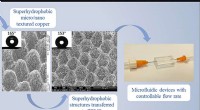 Ny fremstillingsproces skaber supersmå kanaler til at afvise vand og forbedre medicinsk, elektronis…Dette billede viser skabelsen af en superhydrofob overflade på en metaloverflade med en ultrahurtig laser, som overføres til PMDS via transferstøbning og samles til en mikrofluidisk enhed. Kredit:Pu
Ny fremstillingsproces skaber supersmå kanaler til at afvise vand og forbedre medicinsk, elektronis…Dette billede viser skabelsen af en superhydrofob overflade på en metaloverflade med en ultrahurtig laser, som overføres til PMDS via transferstøbning og samles til en mikrofluidisk enhed. Kredit:Pu -
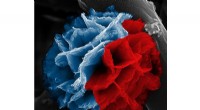 Fremstilling af rustne polymerer til energilagringDette farvede billede viser en poly (3, 4-ethylendioxythiophen) (PEDOT) nanoflower syntetiseret via hydrolyseassisteret dampfasepolymerisation ved hjælp af ethanol som opløsningsmiddel. Den blå farve
Fremstilling af rustne polymerer til energilagringDette farvede billede viser en poly (3, 4-ethylendioxythiophen) (PEDOT) nanoflower syntetiseret via hydrolyseassisteret dampfasepolymerisation ved hjælp af ethanol som opløsningsmiddel. Den blå farve -
 Pig-Pen-effekt:Blanding af hudolie og ozon kan producere en personlig forureningsskyNår ozon rammer olier på huden og i snavset tøj, det kan producere en personlig sky af irriterende stoffer. Kredit:Penn State Når ozon og hudolier mødes, den resulterende reaktion kan hjælpe med a
Pig-Pen-effekt:Blanding af hudolie og ozon kan producere en personlig forureningsskyNår ozon rammer olier på huden og i snavset tøj, det kan producere en personlig sky af irriterende stoffer. Kredit:Penn State Når ozon og hudolier mødes, den resulterende reaktion kan hjælpe med a -
 Hvilke drikkevarer sprænger med umami-potentiale?Kredit:Pixabay/CC0 Public Domain En femte grundsmag er sneget sig ind i vores konceptualisering af fødevarer i de seneste år - umami. på japansk, umami kan groft sagt oversættes til smagfuld lække
Hvilke drikkevarer sprænger med umami-potentiale?Kredit:Pixabay/CC0 Public Domain En femte grundsmag er sneget sig ind i vores konceptualisering af fødevarer i de seneste år - umami. på japansk, umami kan groft sagt oversættes til smagfuld lække
- UMBC-program til at støtte forskellige studerende i STEM med succes replikeret på PSU, UNC
- En ny tilgang til konstruktion af fremtidens materialer
- Har der været Rovers Space -ting på Merkur?
- AgNO3 reagerer med Na2CO3 hvad er ppt-farven?
- Brande stiger i Brazils Amazon, siger forskere
- Fleksible organiske fotovoltaiske celler med in-situ ikke-termisk fotoreduktion af spinbelagte grafe…


