Hvordan beregner du standard enthalpi af neutraliseringshaltsyre og natriumchlorid ved hjælp af CRC -håndbogskemisk fysik?
forståelse af konceptet:
* Standard entalpi af neutralisering: Dette er entalpiændringen, når en mol syre reagerer fuldstændigt med en mol base for at danne en mol vand under standardbetingelser (298 K og 1 atm).
* CRC -håndbog: CRC -håndbogen giver omfattende termodynamiske data, herunder standard enthalpier af dannelse (ΔHF °) for forskellige stoffer.
Problemet:
CRC -håndbogen giver dig ikke en bestemt værdi for entalpien af neutralisering for HCL og NaOH. I stedet skal du beregne det ved hjælp af Hess's lov.
Sådan beregnes entalpien af neutralisering:
1. Skriv den afbalancerede kemiske ligning:
HCL (aq) + NaOH (aq) → NaCl (aq) + h₂o (l)
2. Find standard enthalpier af dannelse (ΔHF °) for hvert reaktant og produkt: Disse data er let tilgængelige i CRC -håndbogen.
3. Anvend Hess's lov: Hess 'lov siger, at entalpienændringen for en reaktion er uafhængig af den taget vej, hvilket betyder, at den kan beregnes ud fra entalpiændringerne af kendte reaktioner.
* ΔH ° (reaktion) =σ [ΔHf ° (produkter)] - σ [ΔHF ° (reaktanter)]
4. tilslut værdierne:
* ΔH ° (neutralisering) =[ΔHf ° (NaCl) + ΔHf ° (H₂O)] - [ΔHF ° (HCI) + ΔHF ° (NaOH)]
5. Beregn resultatet: Udskift værdierne fra CRC -håndbogen for hver forbindelse med ΔHF °.
Eksempel:
Lad os antage (disse værdier er kun til demonstration, slå dem op i din CRC -håndbog):
* ΔHF ° (NaCl) =-411.15 kJ/mol
* ΔHF ° (H₂O) =-285,83 kJ/mol
* ΔHF ° (HCl) =-167,16 kJ/mol
* ΔHF ° (NaOH) =-469,65 kJ/mol
Derefter ville beregningen være:
* ΔH ° (neutralisering) =[(-411.15) + (-285.83)]-[(-167.16) + (-469.65)] =-56.97 kJ/mol
Nøglepunkter:
* Sørg for, at du bruger de korrekte enheder (KJ/Mol).
* Kontroller dobbelt, at de værdier, du bruger fra CRC-håndbogen, er til standardtilstanden (298 K og 1 atm).
* Husk, at entalpien af neutralisering vil være negativ, da dette er en eksoterm reaktion (varme frigøres).
Fortæl mig, hvis du har specifikke værdier for ΔHF ° fra CRC -håndbogen, og jeg kan hjælpe dig med at beregne entalpien af neutralisering for HCL- og NaOH -reaktionen.
 Varme artikler
Varme artikler
-
 Forskere bygger robotforsker, der allerede har opdaget en ny katalysatorMobil robotforsker læsser et stativ med eksperimentelle prøver. Kredit:University of Liverpool Forskere ved University of Liverpool har bygget en intelligent mobil robotforsker, der kan arbejde 24
Forskere bygger robotforsker, der allerede har opdaget en ny katalysatorMobil robotforsker læsser et stativ med eksperimentelle prøver. Kredit:University of Liverpool Forskere ved University of Liverpool har bygget en intelligent mobil robotforsker, der kan arbejde 24 -
 CRISPR udvinder bakteriegenom til skjulte farmaceutiske skatteIllinois-forskere brugte CRISPR-teknologi til at aktivere tavse genklynger i Streptomyces bakterie, en potentiel skatkammer af nye klasser af stoffer. Afbildet, med uret bagfra i midten:kandidatstud
CRISPR udvinder bakteriegenom til skjulte farmaceutiske skatteIllinois-forskere brugte CRISPR-teknologi til at aktivere tavse genklynger i Streptomyces bakterie, en potentiel skatkammer af nye klasser af stoffer. Afbildet, med uret bagfra i midten:kandidatstud -
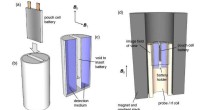 Kemikere udvikler MRI-lignende teknik til at opdage, hvad der fejler batterierEt team af kemikere har udviklet en MRI-baseret teknik, der hurtigt kan diagnosticere, hvad der fejler visse typer batterier - fra at bestemme, hvor meget ladning der er tilbage til at opdage interne
Kemikere udvikler MRI-lignende teknik til at opdage, hvad der fejler batterierEt team af kemikere har udviklet en MRI-baseret teknik, der hurtigt kan diagnosticere, hvad der fejler visse typer batterier - fra at bestemme, hvor meget ladning der er tilbage til at opdage interne -
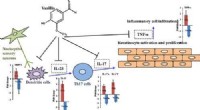 Forebyggelse af psoriasis med vanillinKredit:American Chemical Society Små mængder kunstig vaniljeekstrakt, også kendt som vanillin, findes i en bred vifte af produkter, fra bagværk til parfume. Men vanillins alsidighed stopper ikke d
Forebyggelse af psoriasis med vanillinKredit:American Chemical Society Små mængder kunstig vaniljeekstrakt, også kendt som vanillin, findes i en bred vifte af produkter, fra bagværk til parfume. Men vanillins alsidighed stopper ikke d
- Kan man eje en elbil uden en hjemmeoplader?
- Hvordan en fair aftale for tidligere stålarbejdere ville se ud, når industrien dekarboniseres
- Narrende fusionsbrændstof:Sådan disciplineres uregerligt plasma
- Hvad er kræfterne, når natriumchlorid opløses i vand?
- En ny måde at lede efter livsopretholdende planeter
- Hvad er den bedste måde at lære børn et andetsprog på? Ny forskning giver overraskende resultate…


