En kemiker opløses 3,50 g kaliumiodat og 6,23 hydroxid i 805,05 vand Hvad er den procentvise koncentration hver opløst opløsning?
Forståelse af procentvis koncentration
Procentkoncentration (også kendt som masse/volumenprocent) udtrykker mængden af opløst stof (i gram) opløst i 100 ml opløsning.
Beregninger
1. Total masse af løsning:
* Masse kaliumiodat (KI) =3,50 g
* Mass af kaliumhydroxid (KOH) =6,23 g
* Masse vand (H₂O) =805,05 g
* Samlet masse af opløsning =3,50 g + 6,23 g + 805,05 g =814,78 g
2. procentvis koncentration af kaliumjodat:
* (Mass af Ki / Total Mass of Solution) * 100%
* (3,50 g / 814,78 g) * 100% = 0,43%
3. procentvis koncentration af kaliumhydroxid:
* (Mass af Koh / Total Mass of Solution) * 100%
* (6,23 g / 814,78 g) * 100% = 0,76%
Vigtig note: Løsningen er sandsynligvis meget fortyndet på grund af den store mængde vand.
Fortæl mig, hvis du gerne vil beregne koncentrationen i forskellige enheder (som molaritet eller molalitet)!
Sidste artikelHvad er en Minerloid - give 3 eksempler?
Næste artikelHvad er processen med at producere di nitrogentetroxid?
 Varme artikler
Varme artikler
-
 Billedteknik viser molekylært maskineri på arbejdeDen kamerabaserede billedbehandlingsplatform Scott Blanchard og hans team udviklede til at spore, hvordan individuelle proteiner, kaldet G-proteinkoblede receptorer (GPCRer), reagere på deres omgivels
Billedteknik viser molekylært maskineri på arbejdeDen kamerabaserede billedbehandlingsplatform Scott Blanchard og hans team udviklede til at spore, hvordan individuelle proteiner, kaldet G-proteinkoblede receptorer (GPCRer), reagere på deres omgivels -
 Naturlige fibre trådt ind i satellitter for sikrere missionerKredit:CSIRO En naturlig fiber, der engang indpakkede tidlige egyptiske mumier og blev båret af romerske aristokrater, har fundet et formål i rumalderen. At tråde fibre fra hørplanten gennem satel
Naturlige fibre trådt ind i satellitter for sikrere missionerKredit:CSIRO En naturlig fiber, der engang indpakkede tidlige egyptiske mumier og blev båret af romerske aristokrater, har fundet et formål i rumalderen. At tråde fibre fra hørplanten gennem satel -
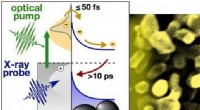 Forskere fanger ærlige øjebliksbilleder af elektroner, der høster lys i atomskalaenIllustration af et PEC-modelsystem med 20-nanometer guld nanopartikler fastgjort til titandioxid. Kredit:Berkeley Lab I søgen efter rene energialternativer til fossile brændstoffer, en lovende løs
Forskere fanger ærlige øjebliksbilleder af elektroner, der høster lys i atomskalaenIllustration af et PEC-modelsystem med 20-nanometer guld nanopartikler fastgjort til titandioxid. Kredit:Berkeley Lab I søgen efter rene energialternativer til fossile brændstoffer, en lovende løs -
 Grønt alternativ til PET kunne være endnu grønnereProfessor i polymerkemi Katja Loos. Kredit:Universitetet i Groningen En af de mest succesrige plasttyper er polyethylenterephthalat (PET), det materiale, vi bruger til at lave flasker og fibre til
Grønt alternativ til PET kunne være endnu grønnereProfessor i polymerkemi Katja Loos. Kredit:Universitetet i Groningen En af de mest succesrige plasttyper er polyethylenterephthalat (PET), det materiale, vi bruger til at lave flasker og fibre til
- Er luft en elementblanding eller forbindelse?
- Ingeniører viser, at roterende magnetiske partikler overraskende følger termodynamiske love
- Hvornår er afstanden tilbagelagt af en partikel proportional med tiden?
- Hvad er højdevinkler og depression?
- Hvad er den lidelse, som nogle kropsceller mister evnen til at kontrollere væksten?
- Hvor meget natrium i København?


