Hvad er processen med at producere di nitrogentetroxid?
Produktion af dinitrogen tetroxid (N2O4)
Dinitrogen tetroxid (N2O4) produceres primært gennem oxidation af nitrogenoxid (NO) . Denne proces involverer flere trin:
1. Oxidation af ammoniak (NH3) til nitrogenoxid (NO):
* Ammoniak oxideres i nærvær af luft og en katalysator (typisk platin- eller platin-rhodiumlegering) ved høje temperaturer (ca. 850-950 ° C).
* Denne reaktion producerer nitrogenoxid (NO) sammen med vanddamp og nitrogen.
* Reaktionsligningen er:
* 4 NH3 + 5 O2 → 4 NO + 6 H2O
2. Oxidation af nitrogenoxid (NO) til kvælstofdioxid (NO2):
* Nitrogenoxid oxideres yderligere af ilt i luften ved omgivelsestemperaturer.
* Denne reaktion producerer nitrogendioxid (NO2).
* Reaktionsligningen er:
* 2 NO + O2 → 2 NO2
3. Dimerisering af nitrogendioxid (NO2) til dinitrogen -tetroxid (N2O4):
* Nitrogendioxid er en meget reaktiv gas, og let dimeriserer (kombineres med sig selv) for at danne dinitrogentetroxid (N2O4) i en ligevægtsreaktion.
* Denne reaktion er temperaturafhængig, hvilket favoriserer dannelsen af N2O4 ved lavere temperaturer.
* Reaktionsligningen er:
* 2 NO2 ⇌ N2O4
4. Oprensning og kondens:
* Den resulterende gasblanding, der indeholder N2O4, renses derefter for at fjerne urenheder som vand og ureageret NO2.
* Den oprensede N2O4 kondenseres derefter til en flydende tilstand ved at afkøle den til omkring -11 ° C.
Bemærk:
* Produktionsprocessen for N2O4 er meget eksoterm og kræver omhyggelig kontrol af temperatur og tryk for at forhindre ukontrollerede reaktioner.
* N2O4 er et meget giftigt og ætsende stof og bør håndteres med ekstrem forsigtighed.
Andre metoder:
* Selvom oxidation af nitrogenoxid er den primære metode til fremstilling af N2O4, findes andre metoder som:
* direkte oxidation af nitrogen: Denne metode bruger en høj-temperatur plasmaaktor og er mindre effektiv end oxidation af nitrogenoxid.
* reaktion af salpetersyre med nitrogendioxid: Denne metode er mindre almindelig og producerer N2O4 som et biprodukt.
Den specifikke produktionsproces og dens detaljer kan variere afhængigt af skalaen og anvendelsen af den producerede N2O4.
 Varme artikler
Varme artikler
-
 Syntetisk slim kan efterligne den ægte vareKredit:ACS Mere end blot et tegn på sygdom, slim er en kritisk del af vores krops forsvar mod sygdom. Hver dag, vores kroppe producerer mere end en liter af det glatte stof, dækker et overfladeare
Syntetisk slim kan efterligne den ægte vareKredit:ACS Mere end blot et tegn på sygdom, slim er en kritisk del af vores krops forsvar mod sygdom. Hver dag, vores kroppe producerer mere end en liter af det glatte stof, dækker et overfladeare -
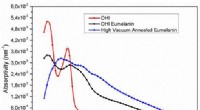 Vil cyborgs blive lavet af melanin? Pigmentgennembrud muliggør biokompatibel elektronikUV-Vis absorptionsevne (procent absorbans/filmtykkelse) af filmene på de forskellige procestrin:(rød, cirkler) DHI; (sort, firkanter) DHI-eumelanin (film efter AISSP); (blå, trekanter) HVAE (film efte
Vil cyborgs blive lavet af melanin? Pigmentgennembrud muliggør biokompatibel elektronikUV-Vis absorptionsevne (procent absorbans/filmtykkelse) af filmene på de forskellige procestrin:(rød, cirkler) DHI; (sort, firkanter) DHI-eumelanin (film efter AISSP); (blå, trekanter) HVAE (film efte -
 Ristning af kakaobønner kan bevare både chokolades sundhedsmæssige fordele, smagForskere undersøgte virkningen af helbønnestegning på de forbindelser, der giver sundhedsmæssige fordele og aroma-relateret kemi under en række stegningsbetingelser. Deres fund tyder på, at kakaoris
Ristning af kakaobønner kan bevare både chokolades sundhedsmæssige fordele, smagForskere undersøgte virkningen af helbønnestegning på de forbindelser, der giver sundhedsmæssige fordele og aroma-relateret kemi under en række stegningsbetingelser. Deres fund tyder på, at kakaoris -
 Ny metode er et væsentligt skridt mod en grønnere medicinalindustriProfessor ved TalTechs afdeling for kemi Riina Aav Kredit:TalTech De hurtige ændringer i den kemiske industri er på den ene side forbundet med udtømning af naturressourcer og uddybning af miljøhen
Ny metode er et væsentligt skridt mod en grønnere medicinalindustriProfessor ved TalTechs afdeling for kemi Riina Aav Kredit:TalTech De hurtige ændringer i den kemiske industri er på den ene side forbundet med udtømning af naturressourcer og uddybning af miljøhen
- Når du aktiverer en øjeblikkelig kold pakning og vand blandes med et kemikalie, får du meget, hvi…
- CERN fejrer færdiggørelsen af Linac 4
- PSR J2055+3829 er en formørkende sort enkepulsar, undersøgelse finder
- Hvad er området omkring en stjerne, der helt rigtige temperatur for livet?
- Vindbestøvede blomster
- Astronomer observerer tidlige stadier af Mælkevejslignende galakser i det fjerne univers


