Hvorfor vil smeltet natriumchlorid udføre elektricitet?
* ioniske forbindelser: Natriumchlorid er en ionisk forbindelse, hvilket betyder, at det dannes af den elektrostatiske tiltrækning mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
* solid tilstand: I sin solide tilstand er ionerne låst i en stiv krystalgitterstruktur. Ionerne kan vibrere, men de kan ikke bevæge sig frit, så de kan ikke udføre elektricitet.
* smeltet tilstand: Når natriumchlorid smelter, svækkes de stærke elektrostatiske kræfter, der holder ionerne sammen. Ionerne slipper fri fra gitteret og bliver mobile. Disse mobile ioner kan nu bære en elektrisk ladning, når der anvendes en potentiel forskel.
* elektrolyse: Når en elektrisk strøm ledes gennem smeltet natriumchlorid, migrerer de positive natriumioner mod den negative elektrode (katode), og de negative chloridioner migrerer mod den positive elektrode (anode). Denne bevægelse af ioner udgør strømmen af elektrisk strøm.
Kortfattet: Smeltet natriumchlorid udfører elektricitet, fordi dets bestanddele er fri til at flytte og bære elektriske ladninger. Denne mobilitet er en direkte konsekvens af forstyrrelsen af krystalgitterstrukturen ved smeltning.
 Varme artikler
Varme artikler
-
 Nye metankoncentrationsteknologier til overvågning af drivhusgasemissionerLosseplads afbrændt flare. Kredit:Eddie Hagler/Public Domain Metankoncentrationerne i atmosfæren er mere end fordoblet i løbet af de sidste 150 år, og reduktion af methanemissioner vil spille en a
Nye metankoncentrationsteknologier til overvågning af drivhusgasemissionerLosseplads afbrændt flare. Kredit:Eddie Hagler/Public Domain Metankoncentrationerne i atmosfæren er mere end fordoblet i løbet af de sidste 150 år, og reduktion af methanemissioner vil spille en a -
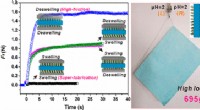 Syntetisk tosidet gekkoerfod kunne muliggøre undervandsrobotikKredit:American Chemical Society Gekkoer er velkendte for ubesværet at klatre op ad vægge og på hovedet over lofter. Selv i glatte regnskove, firbenene bevarer deres greb. Nu har forskere skabt et
Syntetisk tosidet gekkoerfod kunne muliggøre undervandsrobotikKredit:American Chemical Society Gekkoer er velkendte for ubesværet at klatre op ad vægge og på hovedet over lofter. Selv i glatte regnskove, firbenene bevarer deres greb. Nu har forskere skabt et -
 Forskere udvikler en effektiv, lavenergimetode til upcycling af polyethylenplastaffald til værdiful…Kredit:Pixabay/CC0 Public Domain Da vi begyndte at bruge plast for omkring 70 år siden, Der blev ikke tænkt så meget over – om nogen – hvad konsekvenserne af deres levetid havde og det faktum, at
Forskere udvikler en effektiv, lavenergimetode til upcycling af polyethylenplastaffald til værdiful…Kredit:Pixabay/CC0 Public Domain Da vi begyndte at bruge plast for omkring 70 år siden, Der blev ikke tænkt så meget over – om nogen – hvad konsekvenserne af deres levetid havde og det faktum, at -
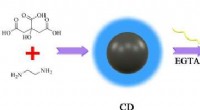 Kulstofprikker gør calcium lettere at sporeIllustration af Ca2+ -detektering ved hjælp af EGTA-modificerede cder. Kredit:SIBET På hospitaler, læger råder ofte patienter til at tage calciumtilskud. Men kommer calcium ind i de celler, der ha
Kulstofprikker gør calcium lettere at sporeIllustration af Ca2+ -detektering ved hjælp af EGTA-modificerede cder. Kredit:SIBET På hospitaler, læger råder ofte patienter til at tage calciumtilskud. Men kommer calcium ind i de celler, der ha
- Hvordan påvirker længden af rotorbladene papirspinderens ophold i luften?
- Sådan finder du vindende sæd:Undersøg deres racerstriber
- Hvad er enheden til at bryde et kredsløb?
- Hvad er rækkevidden mellem Mount Kilimanjaro og Elbrus?
- Vildbrande spredes, fisk dør under alvorlig tørke i Europa
- Trykt elektronik gennembrud kan føre til en fleksibel elektronikrevolution


