Hvorfor vil smeltet natriumchlorid gennemgå elektrolyse?
1. Det indeholder ioner: Smeltet NaCl er en væske, og i denne tilstand er ionerne (Na+ og Cl-) frie til at bevæge sig. Dette giver mulighed for strøm af elektricitet.
2. Det giver en vej til elektronoverførsel: Elektrolyse er processen med at bruge elektricitet til at drive en ikke-spontan kemisk reaktion. Dette kræver et medium, der kan udføre elektricitet, og smeltet NaCl giver denne vej.
3. Det har et lavere nedbrydningspotentiale end elektrodematerialet: For at elektrolyse kan forekomme, skal den anvendte spænding være tilstrækkelig til at overvinde dekomponeringspotentialet for elektrolytten. Molten NaCl har et lavere nedbrydningspotentiale end de elektrodematerialer, der typisk anvendes (som inerte elektroder som grafit).
Her er en sammenbrud af processen:
* katode: Ved den negativt ladede katode får natriumioner (Na+) elektroner og reduceres til natriummetal (NA).
* anode: Ved den positivt ladede anode mister chloridioner (Cl-) elektroner og oxideres til klorgas (CL2).
samlet reaktion:
2NACL (L) → 2NA (L) + CL2 (G)
Kortfattet:
Smeltet natriumchlorid gennemgår elektrolyse, fordi det er en ionisk forbindelse, der, når den er smeltet, giver mulighed for fri bevægelse af ioner og giver en vej til elektronoverførsel. Den påførte spænding er tilstrækkelig til at overvinde nedbrydningspotentialet, drive reaktionen og producere natriummetal og klorgas.
 Varme artikler
Varme artikler
-
 Kasserede cigaretskod - det næste højtydende brintopbevaringsmateriale?Kredit:University of Nottingham Kasserede cigaretskod er en stor affaldsbortskaffelse og miljøforureningsfare. Men kemikere ved University of Nottingham har opdaget, at cigaretskod-afledte carbone
Kasserede cigaretskod - det næste højtydende brintopbevaringsmateriale?Kredit:University of Nottingham Kasserede cigaretskod er en stor affaldsbortskaffelse og miljøforureningsfare. Men kemikere ved University of Nottingham har opdaget, at cigaretskod-afledte carbone -
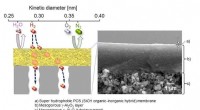 Ny brintbrændstofrensningsmembran baner vejen for en grønnere fremtidEt tværsnitsbillede af selektiv hydrogengennemtrængning i en superhydrofob membran dannet på en porøs rørformet understøtning. Kredit:Yuji Iwamoto fra Nagoya Institute of Technology Brint er bleve
Ny brintbrændstofrensningsmembran baner vejen for en grønnere fremtidEt tværsnitsbillede af selektiv hydrogengennemtrængning i en superhydrofob membran dannet på en porøs rørformet understøtning. Kredit:Yuji Iwamoto fra Nagoya Institute of Technology Brint er bleve -
 En ny måde at skabe molekyler til lægemiddeludviklingUndersøg medforfatter Sean Rafferty i Nagib Lab, hvor kemikere udvikler nye molekyler til udvikling af lægemidler. Kredit:Jeff Grabmeier Kemikere ved Ohio State University har udviklet en ny og fo
En ny måde at skabe molekyler til lægemiddeludviklingUndersøg medforfatter Sean Rafferty i Nagib Lab, hvor kemikere udvikler nye molekyler til udvikling af lægemidler. Kredit:Jeff Grabmeier Kemikere ved Ohio State University har udviklet en ny og fo -
 Test af smartphones tester forgiftet vandrisiko for millioner af livEn smartphone -enhed kan hjælpe millioner af mennesker med at undgå drikkevand, der er forurenet af arsen. Forskere har udviklet en biosensor, der tilsluttes en telefon og bruger bakterier til at opd
Test af smartphones tester forgiftet vandrisiko for millioner af livEn smartphone -enhed kan hjælpe millioner af mennesker med at undgå drikkevand, der er forurenet af arsen. Forskere har udviklet en biosensor, der tilsluttes en telefon og bruger bakterier til at opd
- Sådan konverteres Lumen til Candlepower
- Jerusalem-stedet afslører det gamle judæiske skattecenter
- Hvad hvis Amazonas
- Forklarer:En teoretisk kosmolog beskriver, hvor store sorte huller egentlig er, og point of no retur…
- Hvad er det letteste vægtelement, der ikke er en gas?
- Forskere skaber en kombination af nanopartikel-vaccine for at målrette mod melanom


