Hvilken ladning ville en fluorion sandsynligvis have?
Her er hvorfor:
* fluorens elektronkonfiguration: Fluor har 9 elektroner med den elektroniske konfiguration 2, 7. Dette betyder, at den har 7 elektroner i sin yderste skal (Valence Shell).
* Octet -reglen: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med 8 elektroner i deres yderste skal (oktetreglen).
* At få en elektron: For at fluor at opnå en oktet, er det lettere for det at få en elektron. Dette resulterer i en fuld ydre skal med 8 elektroner og en nettoafgift på -1.
Derfor er en fluorion typisk repræsenteret som f⁻.
Sidste artikelHvorfor er der 7 i ammoniumdikromat?
Næste artikelHvilke mineraler har en hårdhed på 7 på Mohs -skalaen?
 Varme artikler
Varme artikler
-
 Supercomputering af kemiske reaktionerAnimation, der viser den laveste energiovergangstilstand for dannelsen af cyclopentenoner, som findes i et stort antal naturlige produkter, herunder jasminolier, aflatoksiner, og flere prostaglandin
Supercomputering af kemiske reaktionerAnimation, der viser den laveste energiovergangstilstand for dannelsen af cyclopentenoner, som findes i et stort antal naturlige produkter, herunder jasminolier, aflatoksiner, og flere prostaglandin -
 Forskere rapporterer kraftig ionoverførsel i ladet vdW-klynge for første gangSammenfaldskortet viser tidspunktet for flyvninger mellem det første og det andet fragmention, der ankommer til detektoren. Kredit:IMP Siden opdagelsen af den dobbelte helixform af DNA og hypote
Forskere rapporterer kraftig ionoverførsel i ladet vdW-klynge for første gangSammenfaldskortet viser tidspunktet for flyvninger mellem det første og det andet fragmention, der ankommer til detektoren. Kredit:IMP Siden opdagelsen af den dobbelte helixform af DNA og hypote -
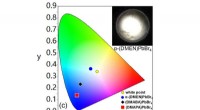 Ændring af den interne struktur af 2-D hybrid perovskit materialer får dem til at udsende hvidt ly…Farvekoordinatkortet illustrerer lysets farver, der udsendes af forskellige hybridperovskitter (med varierende grader af intern strukturel forvrængning) i forhold til ren hvid (svarende til den gule c
Ændring af den interne struktur af 2-D hybrid perovskit materialer får dem til at udsende hvidt ly…Farvekoordinatkortet illustrerer lysets farver, der udsendes af forskellige hybridperovskitter (med varierende grader af intern strukturel forvrængning) i forhold til ren hvid (svarende til den gule c -
 Forskere ser kemisk rækkevidde i mellem-entropi-legeringKredit:CC0 Public Domain Kinesiske forskere har foretaget direkte observationer af ansigtscentrerede kubiske VCoNi (medium) -entropylegeringer (MEA) og for første gang foreslået en overbevisende i
Forskere ser kemisk rækkevidde i mellem-entropi-legeringKredit:CC0 Public Domain Kinesiske forskere har foretaget direkte observationer af ansigtscentrerede kubiske VCoNi (medium) -entropylegeringer (MEA) og for første gang foreslået en overbevisende i


