Hvilken karakteristisk elektronkonfiguration deles af Lithum Sodium Kalium og RB?
Her er en sammenbrud:
* n Repræsenterer det vigtigste kvantetal, hvilket indikerer elektronens energiniveau.
* s Repræsenterer orbitaltypen, som er en sfærisk orbital.
* ¹ Angiver, at der er en elektron i S orbital.
Eksempel:
* lithium (Li): 1S² 2S¹
* natrium (NA): 1S² 2S² 2P⁶ 3S¹
* kalium (k): 1S² 2S² 2P⁶ 3S² 3P⁶ 4S¹
* rubidium (RB): 1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁶ 5S¹
Som du kan se, har hvert element et enkelt elektron i det yderste s orbital. Denne konfiguration er ansvarlig for deres lignende kemiske egenskaber, hvilket gør dem alle meget reaktive alkalimetaller.
 Varme artikler
Varme artikler
-
 Ignorerende store tavse gener lader bakterier producere nye molekyler, potentielle lægemiddelkandid…Illinois -forskere udviklede en teknik til at deaktivere tavse gener i Streptomyces -bakterier ved hjælp af lokke -DNA -fragmenter for at lokke repressorer væk. På billedet, fra venstre:postdoktor Fan
Ignorerende store tavse gener lader bakterier producere nye molekyler, potentielle lægemiddelkandid…Illinois -forskere udviklede en teknik til at deaktivere tavse gener i Streptomyces -bakterier ved hjælp af lokke -DNA -fragmenter for at lokke repressorer væk. På billedet, fra venstre:postdoktor Fan -
 Tegn-selv-elektroder sat til at fremskynde udviklingen af mikrodetektionsenhederEn Iron-Man-formet elektrode trykt ved hjælp af teknikken. Kredit:Imperial College London Miniatureanordninger til sansning af biologiske molekyler kunne udvikles hurtigere takket være en hurtig p
Tegn-selv-elektroder sat til at fremskynde udviklingen af mikrodetektionsenhederEn Iron-Man-formet elektrode trykt ved hjælp af teknikken. Kredit:Imperial College London Miniatureanordninger til sansning af biologiske molekyler kunne udvikles hurtigere takket være en hurtig p -
 Højopløsningsstrukturer af archaerhodopsin-3-proteinet kaster nyt lys over receptordesensibiliseri…Krystaller af AR3 observeret under polariseret lys (venstre). Kredit:Copyright til billederne ligger hos forfatterne i henhold til Nature Communications vilkår og betingelser For første gang, et i
Højopløsningsstrukturer af archaerhodopsin-3-proteinet kaster nyt lys over receptordesensibiliseri…Krystaller af AR3 observeret under polariseret lys (venstre). Kredit:Copyright til billederne ligger hos forfatterne i henhold til Nature Communications vilkår og betingelser For første gang, et i -
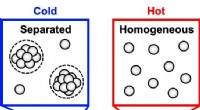 Ny model beskriver faseseparation, der ødelægger antistofopløsningerEn ny undersøgelse brugte en temperaturgradient til at observere, hvor stærkt koncentrerede antistofopløsninger, som dem, der er almindelige i nogle lægemidler, opdelt i faser, som en olie- og vandopl
Ny model beskriver faseseparation, der ødelægger antistofopløsningerEn ny undersøgelse brugte en temperaturgradient til at observere, hvor stærkt koncentrerede antistofopløsninger, som dem, der er almindelige i nogle lægemidler, opdelt i faser, som en olie- og vandopl
- Hvor mange kosmiske år er solen?
- Hvad er en karyotype, og hvordan er kromosomerne arrangeret?
- De ældste fossiler, der nogensinde er fundet, viser, at livet på Jorden begyndte før 3,5 milliard…
- Amazon investerer i opstart af elbiler Rivian
- Hvor det begynder:Unge sultne græshopper vokser i Somalia
- Sådan beregnes den gennemsnitlige absolutte fejl


