Ny model beskriver faseseparation, der ødelægger antistofopløsninger
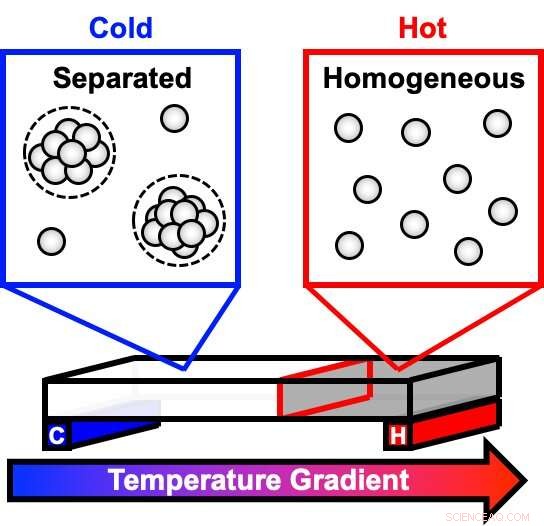
En ny undersøgelse brugte en temperaturgradient til at observere, hvor stærkt koncentrerede antistofopløsninger, som dem, der er almindelige i nogle lægemidler, opdelt i faser, som en olie- og vandopløsning. Ved koldere temperaturer, uklare dråber begynder at danne sig i den engang klare opløsning. Når dråberne vokser og sætter sig til bunden af beholderen, opløsningen opdeles i to forskellige faser. Denne faseseparation kan påvirke et lægemiddels holdbarhed og stabilitet. Kredit:Cremer Lab, Penn State
En ny matematisk model beskriver, hvordan stærkt koncentrerede antistofopløsninger adskiller sig i forskellige faser, ligner en olie- og vandblanding. Denne adskillelse kan reducere stabiliteten og holdbarheden af nogle lægemidler, der bruger monoklonale antistoffer, herunder nogle, der bruges til behandling af autoimmune sygdomme og kræft. Et team af forskere fra Penn State og MedImmune, LLC (nu AstraZeneca) undersøgte termodynamikken og kinetikken, forholdet mellem temperatur, energi, og hastigheden af kemiske reaktioner, af fænomenet ved hjælp af en innovativ metode, der giver mulighed for hurtig undersøgelse af flere prøver på én gang. Et papir, der beskriver deres model, vises 22. juli, 2019, i journalen Procedurer fra National Academy of Sciences .
Mange lægemidler opbevares i dag som faste stoffer og opløses i IV poser til levering til patienter, men medicinalindustrien har bevæget sig mod lægemidler, der kan opbevares som væsker og gives via et skud. Nogle af disse lægemiddelopløsninger, som dem, der bruges til at behandle autoimmune sygdomme og nogle kræftformer, indeholder høje koncentrationer af monoklonale antistoffer - proteiner, der binder sig til fremmede stoffer i kroppen, ligesom bakterier og vira, markerer dem for ødelæggelse af patientens immunsystem.
"Højkoncentrerede proteinopløsninger kan adskilles i forskellige faser, som en vinaigrette salatdressing, der adskiller sig i lag over tid, "sagde Bradley Rogers, kandidatstuderende i kemi ved Penn State og første forfatter af papiret. "Faseseparation er en af de veje, der gør disse lægemidler ustabile og uegnede til brug. Den klassiske metode til at forstå denne proces indebærer manipulering af temperaturen på en prøve over tid. Vi brugte en temperaturgradient mikrofluidikplatform til hurtigt at se på mange temperaturer samtidigt. "
En antistofrig opløsning begynder som en klar væske ved stuetemperatur, men da løsningen afkøles, uklare dråber begynder at danne sig. Over tid, dråberne sætter sig til bunds, med fortyndet væske tilbage på toppen, at få prøven til at se klar ud. Teamet brugte en innovativ enhed, der skaber en række temperaturer over en temperaturgradient og brugte en teknik kaldet mørkfeltbilleddannelse til at måle, hvor hurtigt denne proces sker. Derefter beregnede teamet en række parametre for bedre at forstå systemets termodynamik og kinetik, herunder de temperaturer, ved hvilke faseovergange forekommer, og mængden af energi, det tager at gå fra den ene fase til den næste - aktiveringsenergier.
"Vi observerede, at den hastighed, som en opløsning opdeler i to faser, har en mærkelig afhængighed af temperatur, "sagde Rogers." Dette forhold er meget mere kompliceret for koncentrerede antistofopløsninger, end det er for andre systemer. Vi brugte lang tid på at forsøge at give mening om dataene, men vi udviklede til sidst en model, der forklarer, hvad vi ser. "
Modellen beskriver, hvordan antistofmolekyler hænger sammen, når temperaturen falder, danner dråber, der vokser, når yderligere molekyler slutter sig. Denne reversible proces sker hurtigere og hurtigere med faldende temperatur, fordi opløsningen bliver mere og mere mættet med frie antistofmolekyler. Derefter, da opløsningen fortsætter med at afkøle, dråber holder sig til andre dråber og sætter sig til bunden. Ved endnu koldere temperaturer, opløsningen danner en gel og kan ikke fuldføre separationen, selv i løbet af en måned.
"I et enkelt eksperiment, vi kan visualisere den homogene klare løsning, den uklare løsning, når der begynder at dannes dråber, den faseseparerede væske, og gelen, "sagde Paul Cremer, J. Lloyd Huck Formand i naturvidenskab i Penn State og seniorforfatter af papiret. "Tidligere forskning beskrev disse forskellige tilstande, og vores model beskriver matematik og temperaturafhængig kinetik bag det, vi mener, sker. "
Næste, forskergruppen planlægger at undersøge, om deres model kan forklare faseseparation i andre systemer. De planlægger også at teste, om parametre indsamlet fra denne type eksperimenter kan forudsige stabilitet og holdbarhed af terapier.
"Hvis disse parametre kan hjælpe os med at forudsige stabilitet og holdbarhed, vi kan muligvis udvælge bedre lægemiddelkandidater, "sagde Rogers." Vi kan også være i stand til at bestemme de ideelle løsningsejendomme for en lovende lægemiddelkandidat for at holde den stabil. "
Ud over Rogers og Cremer, the research team includes Kelvin Rembert, Matthew Poyton, Halil Okur, Amanda Kale, and Tinglu Yang at Penn State and Jifeng Zhang from AstraZeneca. The work was supported by MedImmune LLC (now AstraZeneca). Additional support was provided by the National Science Foundation.
 Varme artikler
Varme artikler
-
 Team løser et årti gammelt mysterium i kemiske transformationerPariserhjulet viser den katalytiske carboxylcyklus. Kredit:Cortland Johnson Forskere ved Pacific Northwest National Laboratory (PNNL) har løst et mysterium for en kemisk reaktion, der er afgørende
Team løser et årti gammelt mysterium i kemiske transformationerPariserhjulet viser den katalytiske carboxylcyklus. Kredit:Cortland Johnson Forskere ved Pacific Northwest National Laboratory (PNNL) har løst et mysterium for en kemisk reaktion, der er afgørende -
 Forskere rapporterer om fasestabil uorganisk halogenidperovskitStabil CsSn 1-x PbxI 3 perovskit nanokrystaller. Kredit:University of Electro Communications CsSnI 3 er en prototype af uorganisk halogenidperovskit, der for nylig er blevet foreslået som en
Forskere rapporterer om fasestabil uorganisk halogenidperovskitStabil CsSn 1-x PbxI 3 perovskit nanokrystaller. Kredit:University of Electro Communications CsSnI 3 er en prototype af uorganisk halogenidperovskit, der for nylig er blevet foreslået som en -
 Bakterielle enzymer kapret til at skabe komplekse molekyler, der normalt fremstilles af planterKredit:CC0 Public Domain Kemikere ved Scripps Research har effektivt skabt tre familier af komplekse, oxygenholdige molekyler, der normalt kun kan opnås fra planter. Disse molekyler, kaldet terpe
Bakterielle enzymer kapret til at skabe komplekse molekyler, der normalt fremstilles af planterKredit:CC0 Public Domain Kemikere ved Scripps Research har effektivt skabt tre familier af komplekse, oxygenholdige molekyler, der normalt kun kan opnås fra planter. Disse molekyler, kaldet terpe -
 Årsager til fejl i et kemieksperimentFor en videnskabsmand er definitionen af fejl i nogle tilfælde forskellig fra den normale brug af dette udtryk. En fejl i kemi betyder stadig ofte en fejl, såsom at læse en skala forkert, men det er
Årsager til fejl i et kemieksperimentFor en videnskabsmand er definitionen af fejl i nogle tilfælde forskellig fra den normale brug af dette udtryk. En fejl i kemi betyder stadig ofte en fejl, såsom at læse en skala forkert, men det er
- Den trojanske hestemekanisme:Hvordan netværk reducerer kønsopdeling
- I Israel, søger efter tørke fortid og fremtid
- Politisk konkurrence skader vores velgørende gaver
- Kobberion låser op for magnesium potentiale i næste generations batterier
- En nem måde at reducere socioøkonomiske uligheder på
- Sådan måles et flydende objektets densitet


