Hvilken af disse beholdere er mere flygtige acetonmethanol 2-butanon T-butylchlorid?
Forståelse af volatilitet
Volatilitet henviser til den lethed, hvorpå et stof skifter fra en væske til en gas (fordamper). Faktorer, der påvirker volatiliteten inkluderer:
* Intermolekylære kræfter: Svagere intermolekylære kræfter (som London Dispersion Forces) fører til højere volatilitet. Stærkere kræfter (som hydrogenbinding) mindsker volatiliteten.
* molekylvægt: Lysere molekyler har svagere intermolekylære kræfter og har en tendens til at være mere flygtige.
analyse af forbindelserne
Lad os undersøge hver forbindelse:
* acetone (ch₃coch₃): Har dipol-dipol-interaktioner, men ingen hydrogenbinding.
* Methanol (CH₃OH): Former stærke brintbindinger på grund af tilstedeværelsen af -OH -gruppen.
* 2-butanon (ch₃ch₂coch₃): I lighed med acetone, dipol-dipol-interaktioner, men ingen hydrogenbinding.
* t-butylchlorid (CH₃) ₃CCL: Har kun London -spredningskræfter (svageste intermolekylær kraft).
Konklusion
Baseret på ovenstående analyse:
* t-butylchlorid vil være den mest ustabile, fordi den har de svageste intermolekylære kræfter.
* acetone og 2-butanone vil være mere flygtigt end methanol, fordi de mangler hydrogenbinding.
Derfor er t-butylchlorid den mest flygtige forbindelse blandt de givne indstillinger.
Sidste artikelHvad er lignende mellem kuldioxid og brint?
Næste artikelHvad er den kemiske formel til calciumperchlorat?
 Varme artikler
Varme artikler
-
 Acetone plus lys skaber et grønt jetbrændstoftilsætningsstofStartende med acetone afledt af planter, forskere ved Los Alamos omdanner dette simple molekyle til jetbrændstof ved hjælp af en ny proces, der bruger lys. Dette har potentiale til at blive blandet me
Acetone plus lys skaber et grønt jetbrændstoftilsætningsstofStartende med acetone afledt af planter, forskere ved Los Alamos omdanner dette simple molekyle til jetbrændstof ved hjælp af en ny proces, der bruger lys. Dette har potentiale til at blive blandet me -
 Venetiansk læge havde en central rolle i udformningen af den tidlige moderne kemiSantorios marginale note til kol. 406C-D, i Santorio Santori, Commentaria In Primam Fen Primi Libri Canonis Avicennae (Venedig, 1625), British Library, 542.h.11. Kredit:Santorios marginale note til ko
Venetiansk læge havde en central rolle i udformningen af den tidlige moderne kemiSantorios marginale note til kol. 406C-D, i Santorio Santori, Commentaria In Primam Fen Primi Libri Canonis Avicennae (Venedig, 1625), British Library, 542.h.11. Kredit:Santorios marginale note til ko -
 Forskere designer polymer, der kan dræbe lægemiddelresistente bakterierCo-beta-peptidbehandlingen viser sig at udrydde biofilmbakterier som MRSA, en særlig vanskelig form for bakterier at behandle Kredit:Singapore-MIT Alliance for Research and Technology (SMART) Fors
Forskere designer polymer, der kan dræbe lægemiddelresistente bakterierCo-beta-peptidbehandlingen viser sig at udrydde biofilmbakterier som MRSA, en særlig vanskelig form for bakterier at behandle Kredit:Singapore-MIT Alliance for Research and Technology (SMART) Fors -
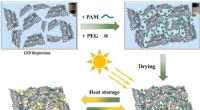 Forskere foreslår et-trins strategi til at syntetisere grafenbaserede sammensatte faseændringsmate…Skematisk diagram af PEG/GO-PAM-sammensatte PCM-syntese. Kredit:LI Yangeng Grafenbaserede kompositfaseforandringsmaterialer (PCMer) udviser et stort potentiale inden for konvertering og lagring af
Forskere foreslår et-trins strategi til at syntetisere grafenbaserede sammensatte faseændringsmate…Skematisk diagram af PEG/GO-PAM-sammensatte PCM-syntese. Kredit:LI Yangeng Grafenbaserede kompositfaseforandringsmaterialer (PCMer) udviser et stort potentiale inden for konvertering og lagring af


