Hvorfor er hydrogenperoxidpolar?
1. Bent molekylær geometri:
* Det centrale iltatom i H₂O₂ har to ensomme par elektroner og to bindingspar, hvilket fører til en bøjet molekylær geometri . Denne geometri skaber en ujævn fordeling af elektrondensitet, hvilket forårsager en adskillelse af ladning inden for molekylet.
2. Elektronegativitetsforskel:
* Oxygen er mere elektronegativ end brint, hvilket betyder, at det tiltrækker elektroner stærkere. Denne forskel i elektronegativitet skaber en delvis negativ ladning (Δ-) På iltatomet og A delvis positiv ladning (Δ+) På hydrogenatomerne.
3. Polære kovalente bindinger:
* Bindingerne mellem ilt og brint i H₂O₂ er polære kovalente bindinger På grund af den ulige deling af elektroner. Dette betyder, at elektronerne er mere tiltrukket af iltatomet, hvilket gør det lidt negativt og brintatomerne lidt positive.
4. Dipolmoment:
* På grund af den bøjede form og de polære kovalente bindinger har molekylet et netto dipolmoment . Dette betyder, at der er en permanent adskillelse af ladning inden for molekylet, hvilket gør det polært.
Generelt resulterer kombinationen af den bøjede molekylære geometri, elektronegativitetsforskellen mellem ilt og brint, og de polære kovalente bindinger i et netto dipolmoment for H₂O₂, hvilket gør det til et polært molekyle.
Sidste artikelLuft består af hovedsageligt ilt sandt eller falskt?
Næste artikelEn form for ilt med en skarp oder?
 Varme artikler
Varme artikler
-
 Nyt batteri tapper kuldioxid opDette scanningselektronmikroskopbillede viser carbonkatoden i et kuldioxidbaseret batteri fremstillet af MIT-forskere, efter at batteriet var afladet. Det viser opbygningen af kulstofforbindelser på
Nyt batteri tapper kuldioxid opDette scanningselektronmikroskopbillede viser carbonkatoden i et kuldioxidbaseret batteri fremstillet af MIT-forskere, efter at batteriet var afladet. Det viser opbygningen af kulstofforbindelser på -
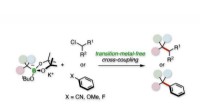 Ny procedure vil reducere behovet for sjældne metaller i kemisk synteseTertiær alkylativ krydskobling af alkyl- eller arylelektrofiler. Kredit:Kanazawa University Medicin, plast, og mange andre kemiske produkter har ændret menneskelivet. For at forberede disse produk
Ny procedure vil reducere behovet for sjældne metaller i kemisk synteseTertiær alkylativ krydskobling af alkyl- eller arylelektrofiler. Kredit:Kanazawa University Medicin, plast, og mange andre kemiske produkter har ændret menneskelivet. For at forberede disse produk -
 Ny biosensor zymonsyre viser ændringer i pH -værdiDr. Franz Schilling (til venstre), Stephan Düwel (i midten) og Christian Hundshammer (th) har udviklet en biosensor, der kan bruges til at vise ændringer i pH -værdien inde i kroppen ved hjælp af MR.
Ny biosensor zymonsyre viser ændringer i pH -værdiDr. Franz Schilling (til venstre), Stephan Düwel (i midten) og Christian Hundshammer (th) har udviklet en biosensor, der kan bruges til at vise ændringer i pH -værdien inde i kroppen ved hjælp af MR. -
 Cerium sidelinjen sølv for at gøre lægemiddel precursorEn mild proces opdaget af Rice University kemikere kunne erstatte vanskelige, sølvbaseret katalyse for at skabe værdifulde fluorketoner, en forløber i design og fremstilling af lægemidler. Kredit:Rene
Cerium sidelinjen sølv for at gøre lægemiddel precursorEn mild proces opdaget af Rice University kemikere kunne erstatte vanskelige, sølvbaseret katalyse for at skabe værdifulde fluorketoner, en forløber i design og fremstilling af lægemidler. Kredit:Rene
- Undersøgelse af glødende glasdråber på ISS
- En pålidelig og effektiv beregningsmetode til at finde overgangstilstande i kemiske reaktioner
- Diesel flyder ikke denne båd-team designer nulemissioner marine forskningsfartøjer
- Hvilken type rock kan enten folieres eller ikke-folieret?
- Afrikas megabyer truet af varme, oversvømmelser, sygdom – handling nødvendig for at starte grønne…
- Hvilken mineralgruppe udgør den højeste procentdel af jordskorpen?


