Kan en stabil forbindelse fremstilles af lithium og ilt?
Her er hvorfor det er stabilt:
* Elektrostatisk attraktion: Lithium (Li) er et meget reaktivt alkalimetal, der let mister et elektron for at blive li⁺. Oxygen (O) er et meget elektronegativt element, der får to elektroner til at blive O²⁻. Den stærke elektrostatiske attraktion mellem de positivt ladede lithiumioner og de negativt ladede oxidioner danner en stabil ionisk binding.
* Krystalgitter: Lithiumoxid danner en stabil krystalgitterstruktur, som yderligere bidrager til dens stabilitet.
Lithiumoxid er et hvidt, krystallinsk fast stof, der bruges i forskellige anvendelser, herunder:
* Keramisk produktion: Det er en almindelig ingrediens i keramik på grund af dets høje smeltepunkt og kemisk stabilitet.
* lithium-ion-batterier: Det fungerer som en komponent i katodematerialet i nogle lithium-ion-batterier.
* Produktion af andre lithiumforbindelser: Det bruges som udgangsmateriale til syntese af andre lithiumforbindelser.
Mens lithiumoxid er stabilt under normale forhold, kan det reagere med vand til dannelse af lithiumhydroxid (LioH), en stærk base.
 Varme artikler
Varme artikler
-
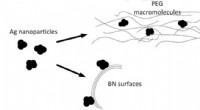 Bornitrid og sølv nanopartikler for at hjælpe med at slippe af med kulilte-emissionerSkemaet med at syntetisere nanohybridkatalysatoren fra lagdelt bornitrid, sølv nanopartikler, og polyethylenglycol. Kredit:Anton S. Konopatsky et al./ Journal of Catalysis , 2018 Russiske kemike
Bornitrid og sølv nanopartikler for at hjælpe med at slippe af med kulilte-emissionerSkemaet med at syntetisere nanohybridkatalysatoren fra lagdelt bornitrid, sølv nanopartikler, og polyethylenglycol. Kredit:Anton S. Konopatsky et al./ Journal of Catalysis , 2018 Russiske kemike -
 Comb alkometer er nu tusind gange mere følsom over for sygdomsbiomarkørerKandidatstuderende Qizhong Liang justerer JILAs frekvenskam-alkometer, som identificerer molekyler forbundet med sygdom baseret på farver og mængder af lys absorberet inde i røret (til venstre), der i
Comb alkometer er nu tusind gange mere følsom over for sygdomsbiomarkørerKandidatstuderende Qizhong Liang justerer JILAs frekvenskam-alkometer, som identificerer molekyler forbundet med sygdom baseret på farver og mængder af lys absorberet inde i røret (til venstre), der i -
 Forskere rekrutterer nye atomare sværvægtere i målrettet kamp mod kræftKatherine Shield (fra venstre), Dahlia An, Tyler Bailey på Lawrence Berkeley National Laboratory tirsdag, 17. november kl. 2020, i Berkeley, Californien Kredit:Marilyn Sargent/Berkeley Lab En love
Forskere rekrutterer nye atomare sværvægtere i målrettet kamp mod kræftKatherine Shield (fra venstre), Dahlia An, Tyler Bailey på Lawrence Berkeley National Laboratory tirsdag, 17. november kl. 2020, i Berkeley, Californien Kredit:Marilyn Sargent/Berkeley Lab En love -
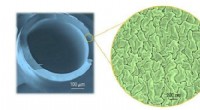 Oprydning med celluloseHoldet skabte velformede hulfibermembraner af cellulose til adskillelse af olie-i-vand-blandinger. Kredit:KAUST Selektivt permeable membraner fremstillet af fornybare plantebaserede materialer kan
Oprydning med celluloseHoldet skabte velformede hulfibermembraner af cellulose til adskillelse af olie-i-vand-blandinger. Kredit:KAUST Selektivt permeable membraner fremstillet af fornybare plantebaserede materialer kan
- Hvilken lys stjerne vises i øst om natten sydafrikansk himmel?
- Revolutionerende ultratynd, flad linse:Smarttelefoner lige så tynde som et kreditkort?
- Hvor mange atomer er der i Mg (OH2) 3?
- Sedimenter fra søer i Japan afslører stabilt klima førte til oprindelsen af landbruget
- Hvordan indtryksbevis virker
- Hvis Betelgeuse går boom:Hvordan DUNE ville reagere på en nærliggende supernova


