Når 127 g kobber reagerer med 32 g iltgas til form II oxid nr eller er tilbage, hvor meget produceret?
1. Skriv den afbalancerede kemiske ligning
Reaktionen mellem kobber (Cu) og ilt (O₂) til dannelse af kobber (II) oxid (CuO) er:
2 cu + o₂ → 2 cuo
2. Beregn mol af reaktanter
* mol kobber:
- Molær kobbermasse (Cu) =63,55 g/mol
- mol Cu =127 g / 63,55 g / mol =2 mol
* mol ilt:
- Molmasse ilt (O₂) =32 g/mol
- mol O₂ =32 g / 32 g / mol =1 mol
3. Bestem den begrænsende reaktant
Den afbalancerede ligning fortæller os, at 2 mol Cu reagerer med 1 mol O₂. Da vi har 2 mol Cu og 1 mol O₂, er ilt den begrænsende reaktant. Dette betyder, at mængden af produceret kobber (II) oxid vil blive bestemt af, hvor meget ilt der er tilgængeligt.
4. Beregn mol af kobber (II) oxid produceret
Fra den afbalancerede ligning ser vi, at 1 mol O₂ producerer 2 mol Cuo.
* Mol Cuo =1 mol O₂ * (2 mol CuO / 1 mol O₂) =2 mol Cuo
5. Beregn massen af kobber (II) oxid produceret
* Molmasse CuO =63,55 g/mol (Cu) + 16,00 g/mol (O) =79,55 g/mol
* Masse Cuo =2 mol Cuo * 79,55 g/mol =159,1 g
Svar:
159,1 g kobber (II) oxid (CUO) vil blive produceret.
Sidste artikelHvad er formlen for aluminium og klor?
Næste artikelKan en stabil forbindelse fremstilles af lithium og ilt?
 Varme artikler
Varme artikler
-
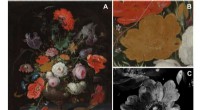 Kemisk og optisk billeddannelse forklarer, hvorfor en rose mistede sin farve i et berømt maleriPigmentnedbrydning i den gule rose i Abraham Mignons Stilleben med blomster og et ur. (A) Visuelt fotografi af stilleben med blomster og et ur af Abraham Mignon (1640-1679), olie på lærred, dateret ca
Kemisk og optisk billeddannelse forklarer, hvorfor en rose mistede sin farve i et berømt maleriPigmentnedbrydning i den gule rose i Abraham Mignons Stilleben med blomster og et ur. (A) Visuelt fotografi af stilleben med blomster og et ur af Abraham Mignon (1640-1679), olie på lærred, dateret ca -
 Grundstoffer kan være faste og flydende på samme tid, undersøgelse afslørerKredit:CC0 Public Domain Forskere har opdaget en ny tilstand af fysisk stof, hvor atomer kan eksistere som både faste og flydende samtidigt. Indtil nu, atomerne i fysisk materiale blev forstået a
Grundstoffer kan være faste og flydende på samme tid, undersøgelse afslørerKredit:CC0 Public Domain Forskere har opdaget en ny tilstand af fysisk stof, hvor atomer kan eksistere som både faste og flydende samtidigt. Indtil nu, atomerne i fysisk materiale blev forstået a -
 Forskere får kontrol over den interne struktur af selvsamlede kompositmaterialerEn model, der viser, hvordan et enkelt lagdelt materiale, afbildet i orange og blå, omdannes til et komplekst arkimedisk struktureret kompositmateriale, når det fryser rundt om en skabelon, afbildet i
Forskere får kontrol over den interne struktur af selvsamlede kompositmaterialerEn model, der viser, hvordan et enkelt lagdelt materiale, afbildet i orange og blå, omdannes til et komplekst arkimedisk struktureret kompositmateriale, når det fryser rundt om en skabelon, afbildet i -
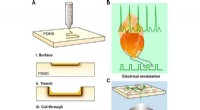 Laserskrivning af nitrogen-doteret siliciumcarbid til biologisk moduleringSkematiske illustrationer af laserskriveprocessen og dens anvendelser. (A) CO2-laser skriver et mønster på et PDMS-substrat, hvor mønsteret kan være (i) på overfladen, (ii) en skyttegrav, eller (iii)
Laserskrivning af nitrogen-doteret siliciumcarbid til biologisk moduleringSkematiske illustrationer af laserskriveprocessen og dens anvendelser. (A) CO2-laser skriver et mønster på et PDMS-substrat, hvor mønsteret kan være (i) på overfladen, (ii) en skyttegrav, eller (iii)
- Nuklear fusion:Det er svært at bygge en stjerne på Jorden, og derfor har vi brug for bedre materia…
- Hvorfor bruges kogende vand i stedet for koldt, når kaliummanganat faldt i vandet?
- Hvorfor strengteori kræver ekstra dimensioner
- Seks grader af adskillelse:Hvorfor det trods alt er en lille verden
- Jern-medieret kræftcelle aktivitet:En ny reguleringsmekanisme
- Hvilken måne ændrer udseendet af det set fra Jorden?


