Kan en 1,446 g prøve af kalium reagerer med 8,178 chlor for at producere chlorid som det eneste produkt?
1. Bestem den begrænsende reaktant:
* Konverter gram til mol:
* Mol k =(1,446 g k) / (39,10 g / mol k) =0,0370 mol K
* Mol Cl =(8,178 g Cl) / (35,45 g / mol Cl) =0,230 mol Cl
* Bestem molforholdet fra den afbalancerede kemiske ligning:
2k + cl₂ → 2KCl
Forholdet er 2 mol af k reagerer med 1 mol Cl₂.
* Beregn molen af Cl₂, der er nødvendig for at reagere med alle k:
(0,0370 mol K) * (1 mol cl₂ / 2 mol k) =0,0185 mol cl₂
* Sammenlign molen af cl₂, der er nødvendig med molen af CL₂ tilgængelig:
0,0185 mol cl₂ (nødvendig) <0,230 mol cl₂ (tilgængelig)
Konklusion: Kalium er den begrænsende reaktant, fordi der ikke er nok af det til at reagere med alt klor.
2. Beregn massen af KCL produceret:
* Brug molforholdet fra den afbalancerede ligning:
(0,0370 mol K) * (2 mol kcl / 2 mol K) =0,0370 mol KCl
* Konverter mol af KCL til gram:
(0,0370 mol KCl) * (74,55 g/mol KCl) =2,76 g KCl
Svar:
1,446 g prøven af kalium reagerer fuldstændigt med en del af 8,178 g klor, der producerer 2,76 g kaliumchlorid (KCL). Der vil være overskydende klor tilbage.
 Varme artikler
Varme artikler
-
 Selvstændig samling i flere trin åbner døren til nye rekonfigurerbare materialerMaterialevidenskab og ingeniørprofessor Qian Chen, centrum, og kandidatstuderende Binbin Luo, venstre, og Ahyoung Kim finder inspiration i biologi til at hjælpe med at undersøge, hvordan orden stammer
Selvstændig samling i flere trin åbner døren til nye rekonfigurerbare materialerMaterialevidenskab og ingeniørprofessor Qian Chen, centrum, og kandidatstuderende Binbin Luo, venstre, og Ahyoung Kim finder inspiration i biologi til at hjælpe med at undersøge, hvordan orden stammer -
 Garn belagt med enzymer kan fungere som filtreOrange biokatalytisk garn med iltbobler. Kredit:Lynn Doby, multimedie specialist, Tekstiler kreative og teknologiske tjenester, Wilson College of Textiles, NC stat. North Carolina State University
Garn belagt med enzymer kan fungere som filtreOrange biokatalytisk garn med iltbobler. Kredit:Lynn Doby, multimedie specialist, Tekstiler kreative og teknologiske tjenester, Wilson College of Textiles, NC stat. North Carolina State University -
 Fysikeres algoritme forudsiger molekylers optiske egenskaberKredit:Tomsk State University Forskere fra Tomsk State University (Rusland), med kolleger fra Sverige og Finland, har skabt en algoritme til beregning af molekylers fotofysiske og luminescerende e
Fysikeres algoritme forudsiger molekylers optiske egenskaberKredit:Tomsk State University Forskere fra Tomsk State University (Rusland), med kolleger fra Sverige og Finland, har skabt en algoritme til beregning af molekylers fotofysiske og luminescerende e -
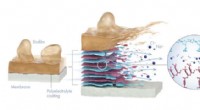 Afskalningsbelægning holder afsaltningen renere og grønnereDen aftagelige polyelektrolytbelægning forhindrer bioforurening på afsaltningsmembraner og undgår behovet for skadelige kemikalier til rengøring af havvandssaltningssystemer. Kredit:© 2020 KAUST; Xavi
Afskalningsbelægning holder afsaltningen renere og grønnereDen aftagelige polyelektrolytbelægning forhindrer bioforurening på afsaltningsmembraner og undgår behovet for skadelige kemikalier til rengøring af havvandssaltningssystemer. Kredit:© 2020 KAUST; Xavi
- Frigivelse af varmen:En ny model til at strømline designet af termisk effektive elektriske kontakte…
- Hvordan er lytiske og lysogene cyklusser de samme?
- Hvem byggede pyramiden af Cestius?
- Forbløffende mangfoldighed af arter rapporteret om Solent østers restaureringsprojekt
- NASA, NOAA-analyser afslører det næstvarmeste år nogensinde i 2019
- Rekordstigning i 2014-2016 globale temperaturer største siden 1900


