Hvordan kan to ustabile elementer såsom natrium og klor kombinere for at fremstille en stabil forbindelse?
1. Elektronkonfiguration:
* natrium (NA): Har 1 valenselektron i sin yderste skal. Den ønsker at miste dette elektron for at opnå en stabil, fyldt ydre skal som den ædle gas neon (NE).
* klor (Cl): Har 7 valenselektroner i sin yderste skal. Den ønsker at få 1 elektron for at opnå en stabil, fyldt ydre skal som den ædle gas argon (AR).
2. Ionisk binding:
* overførsel af elektroner: Natrium, der er ivrig efter at miste et elektron, giver sin valenselektron til klor.
* Dannelse af ioner: Natrium, efter at have mistet et elektron, bliver en positivt ladet ion (Na+). Klor, efter at have fået en elektron, bliver en negativt ladet ion (CL-).
* Elektrostatisk attraktion: De modsatte ladede ioner (Na+ og Cl-) tiltrækkes af hinanden på grund af elektrostatiske kræfter. Denne attraktion holder dem sammen i en stærk ionisk binding.
3. Dannelse af natriumchlorid (NaCl):
* Krystalgitter: De positivt ladede natriumioner og negativt ladede chloridioner arrangerer sig i en regelmæssig tredimensionel struktur kaldet et krystalgitter.
* stabilitet: De stærke elektrostatiske kræfter inden i krystalgitteret stabiliserer forbindelsen. Den samlede ladning af forbindelsen er neutral, med de positive og negative afgifter, der balanserer hinanden.
Sammenfattende resulterer kombinationen af natrium og klor i dannelsen af en stabil forbindelse (natriumchlorid) på grund af overførslen af elektroner, dannelsen af modsat ladede ioner og den stærke elektrostatiske attraktion, der holder ionerne sammen i en stabil krystalgitter.
 Varme artikler
Varme artikler
-
 Faseovergange fører til nye avancerede materialerKredit:Pixabay/CC0 Public Domain Tro det eller ej, Stål har noget til fælles med bakterielle vedhæng:de kan begge gennemgå en særlig form for fysisk transformation, der forbliver forvirrende. Nu,
Faseovergange fører til nye avancerede materialerKredit:Pixabay/CC0 Public Domain Tro det eller ej, Stål har noget til fælles med bakterielle vedhæng:de kan begge gennemgå en særlig form for fysisk transformation, der forbliver forvirrende. Nu, -
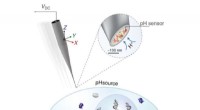 Forbedrede pH -sonder kan hjælpe mod kræftbehandlingerDriften af dobbelt-tønde nanoprobe til samtidig SICM-billeddannelse og pH-måling. Hilsen af Naturkommunikation Kredit:Kanazawa University Nanopipetter med zwitterioniske membraner kan tilbyde
Forbedrede pH -sonder kan hjælpe mod kræftbehandlingerDriften af dobbelt-tønde nanoprobe til samtidig SICM-billeddannelse og pH-måling. Hilsen af Naturkommunikation Kredit:Kanazawa University Nanopipetter med zwitterioniske membraner kan tilbyde -
 Udrugbare sygdomme får et nyt værktøj til opdagelse af RNA-lægemidlerScripps forskningskemiker Matthew Disney, PhD, og kandidatstuderende Blessy Suresh i deres Jupiter, Florida laboratorium. Kredit:Scripps Research Forestil dig, at du prøver at kaste et blik, når d
Udrugbare sygdomme får et nyt værktøj til opdagelse af RNA-lægemidlerScripps forskningskemiker Matthew Disney, PhD, og kandidatstuderende Blessy Suresh i deres Jupiter, Florida laboratorium. Kredit:Scripps Research Forestil dig, at du prøver at kaste et blik, når d -
 Avancerede polymerer hjælper med at strømline vandrensning, miljøsaneringProfessor Xiao Su, venstre, kandidatstuderende Stephen Cotty, centrum, og postdoc-forsker Kwiyong Kim har udviklet et energieffektivt apparat, der selektivt absorberer en meget giftig form for arsen i
Avancerede polymerer hjælper med at strømline vandrensning, miljøsaneringProfessor Xiao Su, venstre, kandidatstuderende Stephen Cotty, centrum, og postdoc-forsker Kwiyong Kim har udviklet et energieffektivt apparat, der selektivt absorberer en meget giftig form for arsen i
- Hvad er alle klimaernes navne?
- Adressering af den svage optiske absorption af grafen
- Showtime for SpaceXs store nye raket med sportsvogn på toppen
- Vulkanudbrud, der opvarmede planeten for millioner af år siden, kaster lys over, hvordan planter ud…
- Forskere tager et nyt kig på Michaelis-Menten-ligningen
- At fange atomer, ikke rumskibe, med traktorbjælker


