Hvilken masse natrium er nødvendigt for at producere 108,2 g oxid?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen af natrium (NA) med ilt (O₂) producerer natriumoxid (Na₂o):
4 na + o₂ → 2 na₂o
2. Bestem den molære masse af natriumoxid (Na₂o):
* NA:22,99 g/mol
* O:16,00 g/mol
Molmasse Na₂o =(2 * 22,99 g/mol) + (1 * 16,00 g/mol) =61,98 g/mol
3. Beregn molen af natriumoxid:
* Mol =masse / molær masse
* Mol Na₂o =108,2 g / 61,98 g / mol =1,746 mol
4. Brug molforholdet fra den afbalancerede ligning til at finde natriummol:
Fra den afbalancerede ligning ser vi, at 4 mol reagerer på at producere 2 mol Na₂o. Derfor er molforholdet 4:2 eller 2:1.
* Mol Na =(2/1) * 1,746 mol =3,492 mol
5. Beregn massen af natrium:
* Masse =mol * molmasse
* Massen af Na =3,492 mol * 22,99 g/mol = 80,3 g
Derfor har du brug for 80,3 g natrium for at producere 108,2 g natriumoxid.
Sidste artikelHvor mange mol i 2,12 g natriumcarbonat?
Næste artikelHvor mange mol natriumsulfat er i 0,1000 g forbindelsen?
 Varme artikler
Varme artikler
-
 Russiske dukkemolekyler kunne virkelig rydde opKiralitet i russiske dukkemolekyler. Kredit:Diamond Light Source Nitschke-gruppen ved University of Cambridge designer hule molekyler, der fungerer som kapsler eller bure, der omslutter gæstemolek
Russiske dukkemolekyler kunne virkelig rydde opKiralitet i russiske dukkemolekyler. Kredit:Diamond Light Source Nitschke-gruppen ved University of Cambridge designer hule molekyler, der fungerer som kapsler eller bure, der omslutter gæstemolek -
 Atomer omarrangeres i elektrolyt og kontrollerer ionstrømmen under hårde forholdGrænsefladen mellem jernrig hæmatit (bund) og vand (øverst) ændres, efterhånden som overfladen bliver elektrisk ladet. Iltatomer (røde) omarrangerer sig på overfladen, udfylde alle steder, hvor der ma
Atomer omarrangeres i elektrolyt og kontrollerer ionstrømmen under hårde forholdGrænsefladen mellem jernrig hæmatit (bund) og vand (øverst) ændres, efterhånden som overfladen bliver elektrisk ladet. Iltatomer (røde) omarrangerer sig på overfladen, udfylde alle steder, hvor der ma -
 Targeting viral RNA:Grundlaget for næste generations bredspektrede antivirale lægemidlerDette er en computergrafik af et RNA -molekyle. Kredit:Richard Feldmann/Wikipedia En ny tilgang til bekæmpelse af vira ved at målrette mod kontrolcenteret i viralt RNA kan føre til bredspektrede a
Targeting viral RNA:Grundlaget for næste generations bredspektrede antivirale lægemidlerDette er en computergrafik af et RNA -molekyle. Kredit:Richard Feldmann/Wikipedia En ny tilgang til bekæmpelse af vira ved at målrette mod kontrolcenteret i viralt RNA kan føre til bredspektrede a -
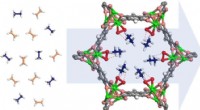 Nyt materiale kunne gøre plastikfremstilling mere energieffektivDenne jernbaserede metal-organiske ramme dekoreret med peroxo-grupper (røde og grønne) kan fange ethan (blå molekyler), mens den tillader ethylen (ferskenmolekyler) at passere igennem, potentielt give
Nyt materiale kunne gøre plastikfremstilling mere energieffektivDenne jernbaserede metal-organiske ramme dekoreret med peroxo-grupper (røde og grønne) kan fange ethan (blå molekyler), mens den tillader ethylen (ferskenmolekyler) at passere igennem, potentielt give


