En grænsedans for amyloid-β, der træder ind i demens
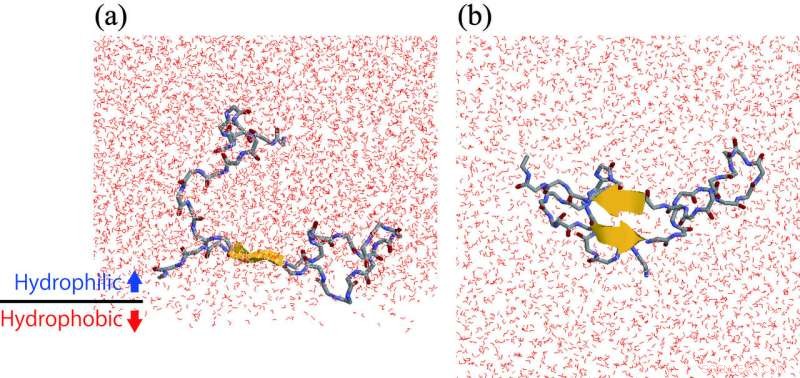
(a) Et Aβ-peptid, der danner en β-hårnålestruktur ved den hydrofile/hydrofobe grænseflade. (b) Udsigt fra bunden af panelet (a). Kredit:ExCELLS/IMS
Alzheimers sygdom er forårsaget af aggregater af amyloid-β (Aβ) peptider. Denne aggregering accelereres ved cellemembranoverfladen. Ved hjælp af molekylær dynamiksimuleringer og NMR -eksperimenter, forskergruppen på ExCELLS har afsløret årsagen til dette fænomen. Resultaterne blev offentliggjort i Journal of Physical Chemistry B .
Mange proteiner samles ved højere koncentrationer og danner sfæriske stoffer kaldet oligomerer og acikulære stoffer kaldet amyloidfibriller. Disse proteinaggregater forårsager mere end 30 slags sygdomme. For eksempel, Alzheimers sygdom menes at være forårsaget af oligomerer og amyloidfibriller dannet ved sammenlægning af amyloid-β (Aβ) peptider. Det er kendt, at aggregering af Ap -peptid accelereres ved en hydrofil/hydrofob grænseflade, såsom en cellemembranoverflade. Imidlertid, hvorfor Aβ -peptiderne har en tendens til at aggregeres på overfladen, er endnu ikke blevet godt forstået.
Forskningsgruppen på Exploratory Research Center on Life and Living Systems og Institute for Molecular Science, Japan, arbejdet på dette problem ved hjælp af molekylære dynamiksimuleringer og kernemagnetisk resonansspektroskopi eksperimenter. De fandt ud af, at Aβ -peptiderne har en tendens til at samle sig ved den hydrofile/hydrofobe grænseflade. Det er, den lokale koncentration af Aβ ved grænsefladen er højere end koncentrationen i bulkvandopløsning. Ud over, β-hårnålstrukturer dannes mere ved grænsefladen end i løsningen af bulkvand. I β-hårnåles strukturen, som vist på figuren, en del af Aβ -peptidet strækker sig lige og danner intramolekylære hydrogenbindinger. Derfor, et andet Aβ -peptid, der kommer tæt på dette peptid, danner let intermolekylære hydrogenbindinger og har en tendens til at aggregeres. På denne måde, forskergruppen præciserede, at aggregeringsacceleration af Aβ -peptiderne på cellemembranoverfladen skyldes en høj koncentration af Aβ -peptider på cellemembranoverfladen, og deres struktur, hvorved de binder til hinanden.
Denne opdagelse belyser den mekanisme, hvormed Aβ -peptidet aggregerer på membranoverfladen af nerveceller. Denne mekanisme kan anvendes til udvikling af hæmmere mod frembringende stoffer i Alzheimers sygdom i fremtiden.
 Varme artikler
Varme artikler
-
 Ny kemisk syntesemetode kan producere en spændende række nye forbindelserForskere ved Nagoya Institute of Technology har etableret en reaktion katalyseret af Bis(imidazolin)/zink, hvorved 2H-aziriner reagerer med phosphit, hvilket giver aziridiner ved et højt enantiomert f
Ny kemisk syntesemetode kan producere en spændende række nye forbindelserForskere ved Nagoya Institute of Technology har etableret en reaktion katalyseret af Bis(imidazolin)/zink, hvorved 2H-aziriner reagerer med phosphit, hvilket giver aziridiner ved et højt enantiomert f -
 En innovativ proces forhindrer irreversibelt energitab i batterieren kemisk prelithieringsmetode til at maksimere ICE for blandingsanoderne ved hjælp af en reduktiv Li-arene kompleks løsning med reguleret solvationskraft, som gør det muligt for en fuld celle at udvi
En innovativ proces forhindrer irreversibelt energitab i batterieren kemisk prelithieringsmetode til at maksimere ICE for blandingsanoderne ved hjælp af en reduktiv Li-arene kompleks løsning med reguleret solvationskraft, som gør det muligt for en fuld celle at udvi -
 Hvordan kan man vide, om et element er en isotop?En isotop er et element, der har en anden mængde neutroner end dets normale atommasse. Nogle isotoper kan være relativt ustabile, og dermed kan de afgive stråling, når atomet nedbrydes. Neutroner er p
Hvordan kan man vide, om et element er en isotop?En isotop er et element, der har en anden mængde neutroner end dets normale atommasse. Nogle isotoper kan være relativt ustabile, og dermed kan de afgive stråling, når atomet nedbrydes. Neutroner er p -
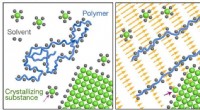 Forbedring af krystalvækst ved hjælp af polyelektrolytopløsninger og forskydningsflowFigur 1. Skema af den formodede mekanisme:polymeren (blå) og den krystalliserende substans (grøn) konkurrerer om delt opløsningsmiddel (grå). Når forskydningsflow er fraværende (venstre), mængden af
Forbedring af krystalvækst ved hjælp af polyelektrolytopløsninger og forskydningsflowFigur 1. Skema af den formodede mekanisme:polymeren (blå) og den krystalliserende substans (grøn) konkurrerer om delt opløsningsmiddel (grå). Når forskydningsflow er fraværende (venstre), mængden af
- Lukning af GM-fabrik forventes ikke at standse Detroits-rebound
- Sådan beregner du diameter fra omkreds
- Planeter omkring andre stjerner er som ærter i en bælte
- Mere end bare økonomisk tab, den sociale indvirkning af spil kan ikke undervurderes
- Singapore kan bruge droner til at levere medicin, for sikkerheden
- Bushfires brændte en femtedel af Australias skov:undersøgelse


