Hvor mange gram kuldioxid ville blive produceret, hvis 45 g C6H12O6 reagerede fuldstændigt med ilt?
1. Skriv den afbalancerede kemiske ligning:
Den afbalancerede kemiske ligning for forbrænding af glukose (C6H12O6) er:
C6H12O6 + 6O2 → 6CO2 + 6H2O
2. Bestem den molære masse af glukose og kuldioxid:
* Glukose (C6H12O6):(6 * 12,01 g/mol) + (12 * 1,01 g/mol) + (6 * 16,00 g/mol) =180,18 g/mol
* Kuldioxid (CO2):(12,01 g/mol) + (2 * 16,00 g/mol) =44,01 g/mol
3. Beregn molen af glukose:
* Mol glukose =(masse af glukose) / (molær masse glukose)
* Mol glukose =(45 g) / (180,18 g / mol) =0,25 mol
4. Brug molforholdet fra den afbalancerede ligning:
Den afbalancerede ligning viser, at 1 mol glukose producerer 6 mol kuldioxid.
5. Beregn molen af det producerede kuldioxid:
* Mol CO2 =(mol glukose) * (6 mol CO2 / 1 mol glukose)
* Mol CO2 =(0,25 mol) * (6) =1,5 mol
6. Beregn massen af kuldioxid:
* Masse CO2 =(mol CO2) * (Molær masse af CO2)
* Masse CO2 =(1,5 mol) * (44,01 g/mol) =66,02 g
Derfor ville 66,02 gram kuldioxid blive produceret, hvis 45 g glukose reagerede fuldstændigt med ilt.
Sidste artikelHvilken er mest reaktiv fluorbrom eller klor?
Næste artikelEr svovl et element eller en forbindelse?
 Varme artikler
Varme artikler
-
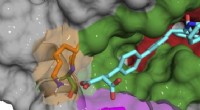 Ny strategi til præcist at målrette undertyper af nøgleproteinRøntgen-co-krystalstruktur af B52-forbindelse (cyan), der binder og hæmmer cyclophilin D-protein. Kredit:Aziz Rangwala Cyclosporin er et af de mest almindelige og effektive immunsuppressive lægemid
Ny strategi til præcist at målrette undertyper af nøgleproteinRøntgen-co-krystalstruktur af B52-forbindelse (cyan), der binder og hæmmer cyclophilin D-protein. Kredit:Aziz Rangwala Cyclosporin er et af de mest almindelige og effektive immunsuppressive lægemid -
 Belysning af stien for cellerNeuroner følger det kortlagte mønster i en hydrogel. Kredit:ETH Zürich ETH -forskere har udviklet en ny metode, hvor de bruger lys til at tegne mønstre af molekyler, der styrer levende celler. Fre
Belysning af stien for cellerNeuroner følger det kortlagte mønster i en hydrogel. Kredit:ETH Zürich ETH -forskere har udviklet en ny metode, hvor de bruger lys til at tegne mønstre af molekyler, der styrer levende celler. Fre -
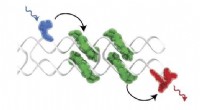 Lær af fotosyntese:Syntetiske kredsløb kan høste lysenergiSet i gråt, DNA DX-flisen danner et stillads, der muliggør en præcis placering af farvestofmolekyle kromoforer, som samler sig selv på stilladset i karakteristiske J-konfigurationer, ses i grønt. Blå
Lær af fotosyntese:Syntetiske kredsløb kan høste lysenergiSet i gråt, DNA DX-flisen danner et stillads, der muliggør en præcis placering af farvestofmolekyle kromoforer, som samler sig selv på stilladset i karakteristiske J-konfigurationer, ses i grønt. Blå -
 Forskere foreslår en ny elektrode til effektiv kunstig syntese af ammoniakIllustration af PEC NRR-processen på BP-elektrode. Kredit:WANG Jiahong Ammoniak (NH 3 ) er et vigtigt kemikalie i industrien og landbruget samt en ny energibærer med stort brintindhold. Som et
Forskere foreslår en ny elektrode til effektiv kunstig syntese af ammoniakIllustration af PEC NRR-processen på BP-elektrode. Kredit:WANG Jiahong Ammoniak (NH 3 ) er et vigtigt kemikalie i industrien og landbruget samt en ny energibærer med stort brintindhold. Som et
- Hvad er oprindelsen af kosmiske love?
- Hvad er det længste stadie af cellecyklus?
- Hvad er en faktor ikke et stærkt bevis for evolution?
- Hvis målingsvinkel 3 er lig med x2 plus 4x, hvad er det muligt for 3?
- Et bærbart tekstilbaseret pneumatisk energihøstsystem til assisterende robotteknologi
- Kryptovalutaer kunne eliminere bankvirksomhedens nemmeste pengeskaber


