Hvordan er vand fysisk anderledes end brint og ilt?
1. Matterilat:
* brint og ilt: Ved stuetemperatur og tryk er begge gasser.
* Vand: Ved stuetemperatur og tryk er vand en væske. Dette skyldes de stærke hydrogenbindinger dannet mellem vandmolekyler.
2. Molekylær struktur:
* brint og ilt: Begge er diatomiske molekyler, hvilket betyder, at de findes som to atomer af det samme element bundet sammen (H₂ og O₂).
* Vand: Vand er et triatomisk molekyle, der består af to hydrogenatomer bundet til et iltatom (H₂O). Denne bøjede form og den polære natur af molekylet giver mulighed for hydrogenbinding.
3. Egenskaber:
* brint og ilt: Begge er farveløse, lugtløse og smagløse gasser. Hydrogen er det letteste element og meget brandfarlige. Oxygen er afgørende for respiration og forbrænding.
* Vand: Vand er en farveløs, lugtfri og smagløs væske. Det er et universelt opløsningsmiddel, hvilket betyder, at det kan opløse mange stoffer. Vand har et højt kogepunkt og en høj overfladespænding på grund af brintbinding.
4. Binding:
* brint og ilt: Begge elementer danner kovalente bindinger inden for deres diatomiske molekyler.
* Vand: Vand danner kovalente bindinger mellem brint- og iltatomer. Derudover dannes hydrogenbindinger mellem forskellige vandmolekyler, hvilket bidrager til dets unikke egenskaber.
5. Kemisk reaktivitet:
* brint og ilt: Begge er meget reaktive elementer. Hydrogen brænder eksplosivt i nærvær af ilt og producerer vand.
* Vand: Vand er relativt stabilt og inert under normale forhold. Det deltager i mange kemiske reaktioner, men det er ikke så reaktivt som dets bestanddele.
I resumé er vand grundlæggende forskelligt fra dets bestanddele, brint og ilt på grund af dets forskellige molekylstruktur, stofstilstand, egenskaber, binding og reaktivitet. Disse forskelle stammer fra dannelsen af stærke brintbindinger mellem vandmolekyler, som giver vand dets unikke egenskaber.
Sidste artikelHvordan fremstilles gas af olie?
Næste artikelMister eller får syrer brintioner?
 Varme artikler
Varme artikler
-
 En metode til at konstruere krystaller med en stor brøkdel af reaktive facetterSkematisk illustration af syntesen af 3D-hm LSMO-katalysatorerne. Kredit:ResearchSEA Alsidige overbygninger sammensat af nanopartikler er for nylig blevet forberedt ved hjælp af forskellige demo
En metode til at konstruere krystaller med en stor brøkdel af reaktive facetterSkematisk illustration af syntesen af 3D-hm LSMO-katalysatorerne. Kredit:ResearchSEA Alsidige overbygninger sammensat af nanopartikler er for nylig blevet forberedt ved hjælp af forskellige demo -
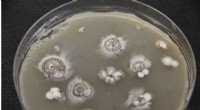 Forskere finder potentielle sygdomsbekæmpende sprænghoveder gemt i bakterierDyrkning af en thiocarboxylsyre producerende stamme af bakterier. Kredit:Shen Lab / The Scripps Research Institute Bakterier fundet i jord kan indeholde en potentiel game-changer for lægemiddeldes
Forskere finder potentielle sygdomsbekæmpende sprænghoveder gemt i bakterierDyrkning af en thiocarboxylsyre producerende stamme af bakterier. Kredit:Shen Lab / The Scripps Research Institute Bakterier fundet i jord kan indeholde en potentiel game-changer for lægemiddeldes -
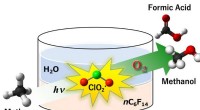 En radikal tilgang til metanoxidation til methanolFig.1:Chlordioxidradikal (ClO2 •) viste sig at virke som et effektivt oxidationsmiddel i den aerobe oxygenering af methan til methanol og myresyre under fotobestråling. Udbyttet af methanol og myresyr
En radikal tilgang til metanoxidation til methanolFig.1:Chlordioxidradikal (ClO2 •) viste sig at virke som et effektivt oxidationsmiddel i den aerobe oxygenering af methan til methanol og myresyre under fotobestråling. Udbyttet af methanol og myresyr -
 Ostfremstilling afhænger af mælkeproteiner for at danne strukturKredit:Pixabay/CC0 Public Domain Osteproduktion er afhængig af koagulation af mælkeproteiner til en gelmatrix efter tilsætning af osteløbe. Mælk, der ikke koagulerer (NC) under optimale forhold på
Ostfremstilling afhænger af mælkeproteiner for at danne strukturKredit:Pixabay/CC0 Public Domain Osteproduktion er afhængig af koagulation af mælkeproteiner til en gelmatrix efter tilsætning af osteløbe. Mælk, der ikke koagulerer (NC) under optimale forhold på


