Hvad er to elementer med egenskaber mest som helium?
Her er hvorfor:
* ædle gasser: Alle tre elementer hører til gruppe 18 (VIIIA) i den periodiske tabel, også kendt som de ædle gasser. Denne gruppe er kendetegnet ved at have en fuld ydre skal af elektroner, hvilket gør dem ekstremt stabile og ureaktive.
* Lignende kemisk opførsel: Helium, neon og argon er alle farveløse, lugtfrie og smagløse gasser ved stuetemperatur. De findes som enkeltatomer og danner ikke let kemiske bindinger med andre elementer.
* Lignende fysiske egenskaber: De har lave kogepunkter og smeltepunkter, og de er dårlige ledere af varme og elektricitet.
Mens neon og argon ligner helium, er der nogle forskelle i deres egenskaber:
* atomstørrelse: Neon og argon er større atomer end helium, med flere protoner og neutroner i deres kerner.
* densitet: Neon og argon er tættere end helium.
* reaktivitet: Mens alle tre er meget ureaktive, er neon og argon endnu mindre reaktive end helium.
Generelt er neon og argon de to elementer, der mest ligner helium med hensyn til deres kemiske og fysiske egenskaber på grund af deres delte position som ædle gasser med en stabil elektronkonfiguration.
Sidste artikelHvor mange atomer er til stede i 41,23 gram natrium?
Næste artikelEr bordsalt et eksempel på et sulfidmineral?
 Varme artikler
Varme artikler
-
 En motorvej for elektroner i oxidheterostrukturerFigur illustrerer vigtigheden af stærk (elektronisk) screening ved bestemmelse af elektronmobiliteten ved grænseflader af oxidheterostrukturer. Den betydelige forbedring af elektronmobilitet kan mul
En motorvej for elektroner i oxidheterostrukturerFigur illustrerer vigtigheden af stærk (elektronisk) screening ved bestemmelse af elektronmobiliteten ved grænseflader af oxidheterostrukturer. Den betydelige forbedring af elektronmobilitet kan mul -
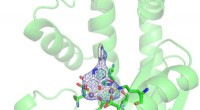 Fremskridt mod en ny influenzabehandling, takket være en lille justeringEt nyt antiviralt lægemiddel hæmmer replikation af influenzas genom ved at binde sig til manganioner (lilla kugler). Kredit:Christine Morrison Dette års uventet aggressive influenzasæson minder al
Fremskridt mod en ny influenzabehandling, takket være en lille justeringEt nyt antiviralt lægemiddel hæmmer replikation af influenzas genom ved at binde sig til manganioner (lilla kugler). Kredit:Christine Morrison Dette års uventet aggressive influenzasæson minder al -
 Rensning af luften:En reduktionsbaseret løsning på nitrogenforurening med en ny katalysatorEn ny jernkatalysator hjælper fortrinsvis med at reducere nitrogenoxid til hydroxylamin, åbne døre til forureningskontrol og ren energi. Kredit:Gwangju Institute of Science and Technology (GIST) V
Rensning af luften:En reduktionsbaseret løsning på nitrogenforurening med en ny katalysatorEn ny jernkatalysator hjælper fortrinsvis med at reducere nitrogenoxid til hydroxylamin, åbne døre til forureningskontrol og ren energi. Kredit:Gwangju Institute of Science and Technology (GIST) V -
 Simulerer manglende evne til at finde styrken i kompositterOptisk billede af et kompositlaminat, der blev brugt i de tværgående fejleksperimenter. Til højre:Repræsentativt billede af en tværgående revne, der spænder over det 90 lag. Som det fremgår af dette o
Simulerer manglende evne til at finde styrken i kompositterOptisk billede af et kompositlaminat, der blev brugt i de tværgående fejleksperimenter. Til højre:Repræsentativt billede af en tværgående revne, der spænder over det 90 lag. Som det fremgår af dette o
- Hvordan bestemmer de kemiske grupper pI af arginin?
- Hvor troværdig er din hunds DNA-test?
- Hydrofracking miljøproblemer er ikke så forskellige fra konventionel boring
- Hemmelighedsfulde mål for CEO-bonusløn signalerer dårlige resultater
- Pandemi tilbyder pause, ikke ende, til globaliseringen
- Her kommer solen på førstegangsbilleder


