Hvordan adskiller natrium- og klorioner fra saltmolekyler?
natrium- og klorioner (Na⁺ og Cl⁻):
* ladede partikler: Dette er individuelle atomer, der har vundet eller mistet elektroner, hvilket giver dem en positiv eller negativ ladning.
* Natrium (NA) mister en elektron og bliver en positivt ladet ion (Na⁺).
* Chlor (CL) får en elektron og bliver en negativt ladet ion (Cl⁻).
* findes uafhængigt: Disse ioner kan eksistere frit i opløsninger som vand eller som en del af en krystalgitter.
* reaktiv: På grund af deres afgift er de meget reaktive og vil let danne obligationer med andre modsat ladede ioner.
saltmolekyler (NaCl):
* neutral forbindelse: Natrium- og klorioner samles gennem en ionisk binding og danner en neutral forbindelse kaldet natriumchlorid (NaCl), almindeligvis kendt som salt.
* stærk elektrostatisk attraktion: De modsatte afgifter for Na⁺ og Cl⁻ skaber en stærk elektrostatisk attraktion, der holder dem sammen i en krystalgitterstruktur.
* ikke individuelle ioner: Saltmolekyler er ikke længere individuelle natrium- eller klorioner. De findes som en enkelt, neutral enhed.
Kortfattet:
* ioner opkræves atomer: De er byggestenene i salt.
* salt er en neutral forbindelse: Det dannes af den elektrostatiske tiltrækning mellem modsat ladede ioner.
Tænk på det sådan:
* lego mursten: Individuelle ioner er som de separate LEGO -mursten. De har en bestemt form og ladning (som forskellige farver).
* LEGO -struktur: Saltmolekyler er som den samlede LEGO -struktur. Murstenene er forbundet og danner en stabil, neutral struktur.
Sidste artikelHvad er densiteten af hexan?
Næste artikelNatriumchromat Hvor mange vandmolekyler pr. Formel?
 Varme artikler
Varme artikler
-
 En type mos kan vise sig at være mere medicinsk effektiv end hampleverurt ( Radula perrottetii ). Kredit:Universitetet i Bern/Stefan Fischer I samarbejde med kolleger fra ETH Zürich, forskere ved universitetet i Bern, Schweiz, har for første gang undersøgt et
En type mos kan vise sig at være mere medicinsk effektiv end hampleverurt ( Radula perrottetii ). Kredit:Universitetet i Bern/Stefan Fischer I samarbejde med kolleger fra ETH Zürich, forskere ved universitetet i Bern, Schweiz, har for første gang undersøgt et -
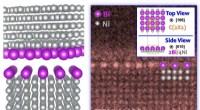 Bestilt, segregation-inducerede overbygninger ved generelle korngrænserAtomistiske modeller og atomopløsning STEM HAADF (scanning transmission elektronmikroskopisk højvinklet ringformet mørkefelt) billeder, der viser tre eksempler på segregation-inducerede overbygninger
Bestilt, segregation-inducerede overbygninger ved generelle korngrænserAtomistiske modeller og atomopløsning STEM HAADF (scanning transmission elektronmikroskopisk højvinklet ringformet mørkefelt) billeder, der viser tre eksempler på segregation-inducerede overbygninger -
 Ny metode til at opdage sygdomme, herunder coronavirus og cystisk fibroseIllustration viser ægteskabet mellem DNA -nanoteknologi og bioelektronik. Kredit:EatFishDesign En ny og hurtigere metode til diagnosticering af sygdomme hos patienter er blevet skabt af forskere v
Ny metode til at opdage sygdomme, herunder coronavirus og cystisk fibroseIllustration viser ægteskabet mellem DNA -nanoteknologi og bioelektronik. Kredit:EatFishDesign En ny og hurtigere metode til diagnosticering af sygdomme hos patienter er blevet skabt af forskere v -
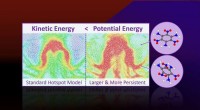 Forskning afdækker manglende fysik i eksplosive hotspotsMolekylær dynamik simuleringer forudsiger, at mere potentiel energi er lokaliseret i hotspots, end deres kinetiske energi (eller temperatur) antyder. Overskydende potentiel energi er bundet til vedvar
Forskning afdækker manglende fysik i eksplosive hotspotsMolekylær dynamik simuleringer forudsiger, at mere potentiel energi er lokaliseret i hotspots, end deres kinetiske energi (eller temperatur) antyder. Overskydende potentiel energi er bundet til vedvar
- Mysteriesignal fra rummet er løst. Det er ikke aliens
- Brandmænd forsøger at forhindre, at græske øflammer når skoven
- NASA-NOAAs Suomi NPP-satellit fanger tyfonen Yutu i styrkelse, Guam i alarmberedskab
- Forskere får det første fuldstændige kig på protein bag følesansen
- Er Ubers bilservice virkelig 40 milliarder dollar værd?
- Hvor mange carbonatomer er til stede i 1,0 x 10-4 mol kulstof?


