Forklar den relative opløselighed af jod i vand?
* ikke -polær natur: Jod (I₂) er et ikke -polært molekyle. Dette betyder, at elektronerne deles jævnt mellem de to jodatomer, hvilket resulterer i ingen signifikant ladningsforskel på tværs af molekylet.
* Polar karakter af vand: Vand (H₂O) er et polært molekyle. Oxygenatomet har en delvis negativ ladning, og brintatomerne har delvis positive ladninger.
* "som opløser som": Princippet om "som opløser som" angiver, at polære opløsningsmidler opløser polære opløste stoffer og ikke -polære opløsningsmidler opløser ikke -polære opløste stoffer. Da jod er ikke -polært og vand er polært, er de ikke kompatible.
Faktorer, der bidrager til lav opløselighed:
* svage intermolekylære kræfter: Jodmolekyler interagerer med hinanden gennem svage London -spredningskræfter. Vandmolekyler interagerer gennem stærke brintbindinger. Forskellen i intermolekylære kræfter gør det vanskeligt for jodmolekyler at bryde ind i vandstrukturen.
* Begrænset interaktion: Jodmolekyler kan ikke danne signifikante interaktioner med vandmolekyler, hvilket hindrer dens evne til at opløses.
Imidlertid kan jodens opløselighed øges med:
* Tilstedeværelse af iodidioner: Jod kan reagere med iodidioner (I⁻) for at danne triiodidioner (I₃⁻), som er mere opløselige i vand på grund af deres øgede polaritet.
* Brug af organiske opløsningsmidler: Jod er meget mere opløselig i ikke -polære organiske opløsningsmidler som hexan eller carbontetrachlorid.
Kortfattet: Jodens ikke -polære natur og svage interaktioner med vand gør det dårligt opløseligt i vand. Dette er et klassisk eksempel på "som opløser som" princip.
Sidste artikelHvad er nogle farveløse gasser?
Næste artikelCarbon reagerer med fortyndet saltsyre?
 Varme artikler
Varme artikler
-
 Hvordan computere søger efter fremtidens stofferKredit:University of California, San Francisco Opdagelse af lægemidler kan bringe tankerne hen på billeder af hvide laboratoriefrakker og pipetter, men da Henry Lin, PhD, for nylig satte sig for a
Hvordan computere søger efter fremtidens stofferKredit:University of California, San Francisco Opdagelse af lægemidler kan bringe tankerne hen på billeder af hvide laboratoriefrakker og pipetter, men da Henry Lin, PhD, for nylig satte sig for a -
 En ny klasse af membraner lover interessante anvendelser inden for materialeadskillelseDen nye klasse af membraner kunne med succes bruges til adskillelse. Kredit:Forfattere af undersøgelsen En ny klasse af membraner lover meget interessante anvendelser inden for materialeadskillels
En ny klasse af membraner lover interessante anvendelser inden for materialeadskillelseDen nye klasse af membraner kunne med succes bruges til adskillelse. Kredit:Forfattere af undersøgelsen En ny klasse af membraner lover meget interessante anvendelser inden for materialeadskillels -
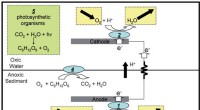 NRL udstedt patent for solar mikrobiel brændselscelleSkematisk skildring af forenklet mekanisme til energiproduktion af den bentiske mikrobielle brændselscelle (BMFC), uden boks mærket 5 svarende til fotosyntese, og for den mikrobielle fotoelektrokemisk
NRL udstedt patent for solar mikrobiel brændselscelleSkematisk skildring af forenklet mekanisme til energiproduktion af den bentiske mikrobielle brændselscelle (BMFC), uden boks mærket 5 svarende til fotosyntese, og for den mikrobielle fotoelektrokemisk -
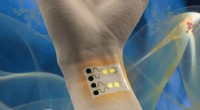 En bærbar gassensor til sundheds- og miljøovervågningEn bærbar gassensor kan overvåge miljømæssige og medicinske forhold. Kredit:Cheng Lab/Penn State En meget følsom, Bærbar gassensor til miljø- og sundhedsovervågning kan snart blive kommercielt til
En bærbar gassensor til sundheds- og miljøovervågningEn bærbar gassensor kan overvåge miljømæssige og medicinske forhold. Kredit:Cheng Lab/Penn State En meget følsom, Bærbar gassensor til miljø- og sundhedsovervågning kan snart blive kommercielt til
- Første exoplanetbillede fra James Webb Space Telescope afsløret
- Solar Systems Science Fair Projects for Second Grade
- Fysikere udvikler en mere præcis løsning på kvante-tre-kropsproblemet
- Forøgelse af IPO-performance ved at afsløre innovationsplaner:Hvordan virksomheder kan afbøde den…
- Hvilke elementer reagerer med saltsyre?
- Maskinlæringsalgoritme forudsiger, hvordan gener reguleres i individuelle celler


