Brug af siliciumdioxid som et eksempel og den periodiske tabel en reference. Beskriv hvordan man skriver formlen med kovalent forbindelse.?
1. Identificer elementerne
* Silicium (SI) er i gruppe 14 (IVA) i den periodiske tabel.
* Oxygen (O) er i gruppe 16 (via) i den periodiske tabel.
2. Bestem antallet af valenselektroner
* Silicium har 4 valenselektroner (det er i gruppe 14).
* Oxygen har 6 valenselektroner (det er i gruppe 16).
3. Bestem det ønskede antal obligationer
* Silicium skal danne 4 bindinger for at opnå en stabil oktet (8 elektroner i dens ydre skal).
* Oxygen skal danne 2 obligationer for at opnå en stabil oktet.
4. Find det enkleste forhold
* For at opfylde bindingskravene kan et siliciumatom binde med to iltatomer. Dette er repræsenteret af formlen sio₂ .
5. Skriv formlen
* Formlen for den kovalente forbindelse er skrevet med det element, der er mindre elektronegativ (i dette tilfælde silicium) først, efterfulgt af det element, der er mere elektronegativ (ilt). Underskrifterne angiver antallet af atomer i hvert element i molekylet.
Nøglepunkter:
* kovalente forbindelser: Atomer deler elektroner for at opnå stabilitet.
* Elektronegativitet: Et mål for et atoms evne til at tiltrække elektroner. Det mere elektronegative atom er typisk skrevet sidst i formlen.
* octet regel: De fleste atomer stræber efter at have otte elektroner i deres yderste skal (bortset fra brint, der søger to).
Lad os se på et andet eksempel:
kuldioxid (co₂)
* carbon (Gruppe 14) har 4 valenselektroner.
* ilt (Gruppe 16) har 6 valenselektroner.
* Et carbonatom kan danne dobbeltbindinger med to iltatomer, der tilfredsstiller oktetreglen for alle atomer.
Derfor er formlen for kuldioxid co₂.
Sidste artikelHvilken type bindinger mellem svovl- og iltatomer?
Næste artikelEr jernsulfat det samme som folinsyre?
 Varme artikler
Varme artikler
-
 Touchscreen-alternativ dæmper frygten for verdensmangel på indiumDet nye materiale er skabt ved hjælp af en proces kaldet plasmasputtering. Kredit:Behnam Akhavan Har du nogensinde forestillet dig din smartphone eller tablet uden en berøringsskærm? Dette kan sna
Touchscreen-alternativ dæmper frygten for verdensmangel på indiumDet nye materiale er skabt ved hjælp af en proces kaldet plasmasputtering. Kredit:Behnam Akhavan Har du nogensinde forestillet dig din smartphone eller tablet uden en berøringsskærm? Dette kan sna -
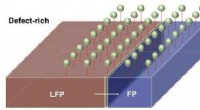 Forskere viser punktdefekter i katodekrystaller kan fremskynde lithiumabsorptionEn illustration viser et batteris katode, der gennemgår faseovergang fra jernfosfat (FP) til lithiumjernfosfat (LFP) under opladning. Simuleringer fra Rice University-forskere viste, at tilføjelse af
Forskere viser punktdefekter i katodekrystaller kan fremskynde lithiumabsorptionEn illustration viser et batteris katode, der gennemgår faseovergang fra jernfosfat (FP) til lithiumjernfosfat (LFP) under opladning. Simuleringer fra Rice University-forskere viste, at tilføjelse af -
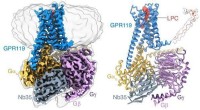 Undersøgelse afslører ligandgenkendelsesmekanisme for forældreløs receptor GPR119Identifikation af LPCet bundet til GPR119-Gs-komplekset ved hjælp af cryo-EM. Kredit:Peiyu Xu fra H. Eric Xus laboratorium Metaboliske sygdomme, herunder diabetes, fedtlever og fedme, er blevet en
Undersøgelse afslører ligandgenkendelsesmekanisme for forældreløs receptor GPR119Identifikation af LPCet bundet til GPR119-Gs-komplekset ved hjælp af cryo-EM. Kredit:Peiyu Xu fra H. Eric Xus laboratorium Metaboliske sygdomme, herunder diabetes, fedtlever og fedme, er blevet en -
 Fange solen:Ny tyndfilmsteknologi bruger bæredygtige komponenter til solpanelerI umiddelbar nærhed af vores hjem og liv, solpaneler er de mest effektive, når de er billige og ikke-giftige. DGIST-teamet forberedte CZTSSe-solceller i laboratorieskala, og en af dem viste en uafgj
Fange solen:Ny tyndfilmsteknologi bruger bæredygtige komponenter til solpanelerI umiddelbar nærhed af vores hjem og liv, solpaneler er de mest effektive, når de er billige og ikke-giftige. DGIST-teamet forberedte CZTSSe-solceller i laboratorieskala, og en af dem viste en uafgj


