Undersøgelse afslører ligandgenkendelsesmekanisme for forældreløs receptor GPR119
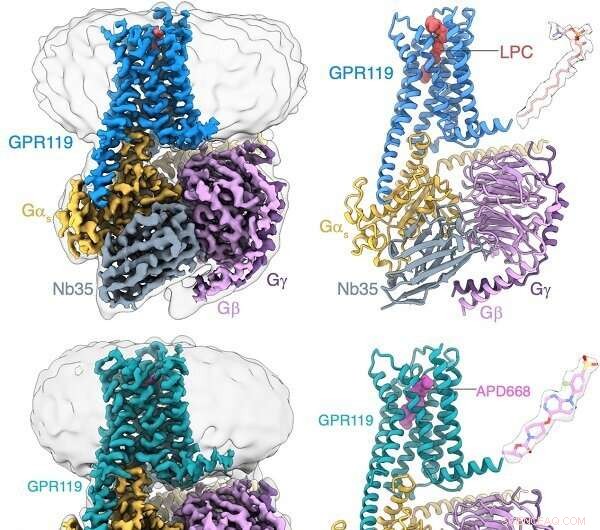
Identifikation af LPC'et bundet til GPR119-Gs-komplekset ved hjælp af cryo-EM. Kredit:Peiyu Xu fra H. Eric Xus laboratorium
Metaboliske sygdomme, herunder diabetes, fedtlever og fedme, er blevet en stor "dræber", der påvirker menneskers sundhed. Undersøgelser har vist, at nogle forældreløse receptorer kan være mål for behandlingen af disse sygdomme. GPR119, også kendt som glucoseafhængig insulinotropisk receptor, er en forældreløs receptor i den G-proteinkoblede receptor (GPCR) superfamilie. Aktivering af GPR119 kan stimulere udskillelsen af glucagon-lignende peptid-1 (GLP-1) og glucose-afhængig insulin-releasing polypeptid (GIP), to hormoner, der er vigtige for at regulere balancen i glukosemetabolismen i kroppen.
GPR119 betragtes som et potentielt lægemiddelmål til behandling af diabetes, fedtlever, fedme og andre stofskiftesygdomme. I de senere år er adskillige små-molekylære agonister af GPR119 blevet udviklet af farmakologer. Imidlertid er lægemiddelopdagelse af GPR119 begrænset af manglen på strukturel forståelse af genkendelsen af ligander til receptoren.
I en undersøgelse offentliggjort i Nature Structural &Molecular Biology , et team af forskere ledet af H. Eric Xu (Xu Huaqiang) og Xie Xin fra Shanghai Institute of Materia Medica (SIMM) fra det kinesiske videnskabsakademi og Jiang Yi fra Lingang Laboratory, gav strukturel indsigt i bindingen af GPR119 til den endogene ligand lysophosphatidylcholiner (LPC) og lægemiddelkandidaten APD668.
Gennem strukturel biologi, biokemi og funktionelle undersøgelser identificerede forskere, at GPR119 fortrinsvis kunne binde den endogene ligand LPC. Strukturel analyse afslørede, at den ligandbindende lomme af GPR119 bestod af en hydrofob lomme og en hydrofil lomme. Navnlig blev der dannet en åbning i den centrale del af det transmembrane domæne, hvilket var et unikt træk fra andre GPCR'er og gav et gunstigt bindingsrum for LPC og et andet potentielt indgangssted for ligander.
Yderligere undersøgelser af strukturen af GPR119 i kompleks med APD668, en lægemiddelkandidat til diabetesbehandling, afslørede, at den stive strukturelle rygrad af APD668 dannede potente interaktioner med den hydrofobe lomme af GPR119. Høj opløsning af strukturen afslørede "vippekontakten", vigtige rester til at skifte aktivering af GPCR'er. GPR119 udviste en unik afbøjningstilstand fra andre GPCR'er under receptoraktivering. Et vandmolekyle blev observeret at danne hydrogenbindinger med rester for at stabilisere den aktiverede tilstand af GPR119. Derudover afslørede den strukturelle analyse den unikke genkendelsesmåde af GPR119 til downstream-signalmolekylet Gs-protein.
Denne undersøgelse afslørede den molekylære mekanisme for ligandbinding, receptoraktivering og G-proteinkobling af forældreløs receptor GPR119 og gav strukturelle skabeloner og indsigt i udviklingen af nye lægemidler rettet mod GPR119 til behandling af metaboliske sygdomme. + Udforsk yderligere
En G-protein-koblet receptor kan være et lægemiddelmål for ikke-alkoholisk fedtleversygdom
 Varme artikler
Varme artikler
-
 Kemiker udvikler 3D-simuleringer af proteiner til spike i coronavirusAnimation, der viser, hvordan coronavirus -spike -protein ændrer form lige før det bindes til human celleceptor. Kredit:Illustration leveret af Mahmoud Moradi. Beregningskemiker Mahmoud Moradi vil
Kemiker udvikler 3D-simuleringer af proteiner til spike i coronavirusAnimation, der viser, hvordan coronavirus -spike -protein ændrer form lige før det bindes til human celleceptor. Kredit:Illustration leveret af Mahmoud Moradi. Beregningskemiker Mahmoud Moradi vil -
 Synergistiske katalysatorer til højeffektiv brintlagringGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121958 Brintenergi betragtes som lovende vedvarende energi. Udviklingen af brintenergi er imidlertid begrænset
Synergistiske katalysatorer til højeffektiv brintlagringGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121958 Brintenergi betragtes som lovende vedvarende energi. Udviklingen af brintenergi er imidlertid begrænset -
 Generelle karakteristika ved syre og baser <p> <p> Syrer og baser er forbindelser med en vigtig ting…Den ældgamle test for syrer og baser, litmus papir er filterpapir der er blevet behandlet med farvestoffer fremstillet af lav. En syre bliver blå lakmapapir rød, mens en base bliver rød lakmapapir blå
Generelle karakteristika ved syre og baser <p> <p> Syrer og baser er forbindelser med en vigtig ting…Den ældgamle test for syrer og baser, litmus papir er filterpapir der er blevet behandlet med farvestoffer fremstillet af lav. En syre bliver blå lakmapapir rød, mens en base bliver rød lakmapapir blå -
 Elektroner øger faststof kaloriekøling i hexagonale sulfiderEt skitsekort for mekanismen for kæmpe barokalorisk (BC) effekt i Ni1-xFexS (op mønster). En sammenligning af volumennormaliseret entropiændring drevet af 100 MPa og termisk ledningsevne (k) for Ni 0
Elektroner øger faststof kaloriekøling i hexagonale sulfiderEt skitsekort for mekanismen for kæmpe barokalorisk (BC) effekt i Ni1-xFexS (op mønster). En sammenligning af volumennormaliseret entropiændring drevet af 100 MPa og termisk ledningsevne (k) for Ni 0
- Hvordan påvirker kerneenergi miljøet?
- Storbritanniens telegigant BT -akser 13, 000 job
- Ny metode til mikrobiel energiproduktion opdaget
- AI-drevne sko låser op for hemmelighederne bag din sål
- Nøglen til forbedret grøn teknologieffektivitet fundet i simpel syrebehandling
- Oversvømmelsesfrekvensen af verdens største flod er femdoblet


