Hvorfor kan vand opløses så mange forbindelser?
1. Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ladning i den ene ende (hydrogenatomer) og en lidt negativ ladning på det andet (iltatom). Denne polaritet giver vand mulighed for at interagere med og opløse andre polære molekyler, såsom sukker og salte.
2. Hydrogenbinding: De lidt positive hydrogenatomer i et vandmolekyle kan danne svage bindinger kaldet hydrogenbindinger med det lidt negative iltatom i et andet vandmolekyle. Dette stærke netværk af brintbindinger giver vand sine høje sammenhængende kræfter og overfladespænding, hvilket hjælper det med at trække ioniske forbindelser fra hinanden.
3. Høj dielektrisk konstant: Vand har en høj dielektrisk konstant, hvilket betyder, at det effektivt kan svække de elektrostatiske kræfter, der holder ioner sammen i ioniske forbindelser. Dette gør det muligt for vand at adskille ionerne og omringe dem individuelt, hvilket effektivt opløses forbindelsen.
4. Universelt opløsningsmiddel: Vands evne til at opløse en lang række stoffer gør det til et "universelt opløsningsmiddel". Denne egenskab er afgørende for livet, hvilket muliggør transport og reaktion af næringsstoffer og affaldsprodukter i levende organismer.
Specifikke eksempler:
* ioniske forbindelser: Vand kan opløse ioniske forbindelser som natriumchlorid (NaCI) ved at omringe de individuelle ioner (Na+ og Cl-) og svække deres elektrostatiske tiltrækning.
* polære molekyler: Vand kan opløse polære molekyler som sukker ved at danne brintbindinger med de polære grupper på sukkermolekylet.
* Gasser: Nogle gasser, som kuldioxid, kan opløses i vand på grund af deres evne til at danne svage interaktioner med vandmolekyler.
Begrænsninger:
Mens vand er et fremragende opløsningsmiddel, opløses det ikke alt. Det har svært ved at opløse ikke -polære stoffer som fedt og olier på grund af deres mangel på polære grupper, som vand kan interagere med.
Afslutningsvis gør vandets unikke kombination af polaritet, hydrogenbinding, høj dielektrisk konstant og dens evne til at danne forskellige interaktioner med forskellige molekyler det til et kraftfuldt og alsidigt opløsningsmiddel. Denne egenskab er vigtig for mange biologiske og kemiske processer, hvilket gør vand til en uundværlig komponent i livet på jorden.
Sidste artikelHvad er vandopløselige forbindelser?
Næste artikelHvad er resultaterne fra AL -reaktionen med Koh?
 Varme artikler
Varme artikler
-
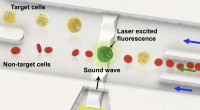 Forskere udviklede enkeltcelleniveau sorteringsteknologi ved hjælp af lydbølgerSkematisk over den fluorescensaktiverede sortering af en enkelt målcelle i en heterogen celleprøve. Kredit:SUTD/Ye Ai Lydbølger muliggør fornemmelsen af hørelse, og er en vigtig måde at kommunik
Forskere udviklede enkeltcelleniveau sorteringsteknologi ved hjælp af lydbølgerSkematisk over den fluorescensaktiverede sortering af en enkelt målcelle i en heterogen celleprøve. Kredit:SUTD/Ye Ai Lydbølger muliggør fornemmelsen af hørelse, og er en vigtig måde at kommunik -
 Forskere patenterer hurtige tests for kokainFIU biokemi Ph.D. studerende Haixiang Yu, kemi Ph.D. studerende Juan Canoura, og nyuddannet Obtin Alkhamis offentliggjorde en undersøgelse af FIUs patenterede kokaindetektionsteknologier. Kredit:Flori
Forskere patenterer hurtige tests for kokainFIU biokemi Ph.D. studerende Haixiang Yu, kemi Ph.D. studerende Juan Canoura, og nyuddannet Obtin Alkhamis offentliggjorde en undersøgelse af FIUs patenterede kokaindetektionsteknologier. Kredit:Flori -
 Nyt atlas med lipidform er nøglen til tidlig sygdomsdetektionLipidatlasset bygget af Vanderbilt University kemikere kan tilføjes, når andre forskere begynder at afkode molekyleformer. Kredit:The McLean Group Hver en smule information om en persons helbred -
Nyt atlas med lipidform er nøglen til tidlig sygdomsdetektionLipidatlasset bygget af Vanderbilt University kemikere kan tilføjes, når andre forskere begynder at afkode molekyleformer. Kredit:The McLean Group Hver en smule information om en persons helbred - -
 Selvhelbredende beton kan mangedoble strukturers levetidProf. Rahbar viser ophelet beton. Kredit:Worcester Polytechnic Institute Forskere ved Worcester Polytechnic Institute (WPI) bruger et enzym, der findes i røde blodlegemer, til at skabe selvhelbred
Selvhelbredende beton kan mangedoble strukturers levetidProf. Rahbar viser ophelet beton. Kredit:Worcester Polytechnic Institute Forskere ved Worcester Polytechnic Institute (WPI) bruger et enzym, der findes i røde blodlegemer, til at skabe selvhelbred


