Hvad reagerer med syrer for at give et salt og vand?
Her er en sammenbrud:
* syrer er stoffer, der donerer brintioner (H+) i opløsning. De har normalt en sur smag og kan blive blåt lakmuspapir rød.
* baser er stoffer, der accepterer brintioner (H+) i opløsning. De har normalt en bitter smag og kan blive rød lakmuspapirblå.
* metalhydroxider er forbindelser, der indeholder en metalkation og hydroxidanion (OH-). Eksempler inkluderer natriumhydroxid (NaOH), kaliumhydroxid (KOH) og calciumhydroxid (Ca (OH) 2).
* metaloxider er forbindelser, der indeholder en metalkation og oxidanion (O2-). Nogle metaloxider reagerer med syrer for at danne salte og vand. Eksempler inkluderer magnesiumoxid (MGO) og kobberoxid (CUO).
Generel ligning for neutralisering:
Syre + base → salt + vand
Eksempel:
* Hydrochlorsyre (HCI), der reagerer med natriumhydroxid (NaOH) :
HCL (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
* svovlsyre (H2SO4) reagerer med kobberoxid (CUO) :
H2SO4 (aq) + cuo (s) → CUSO4 (aq) + H2O (l)
Nøglepunkter:
* SALT dannet i en neutraliseringsreaktion er en forbindelse, der indeholder kationen fra basen og anionen fra syren.
* Vand produceres altid som et produkt i en neutraliseringsreaktion.
* Reaktionen er eksoterm, hvilket betyder, at den frigiver varme.
Husk, at ikke alle baser reagerer med syrer for at danne salte og vand. Nogle baser, som ammoniak (NH3), reagerer i stedet for at danne ammoniumsalte.
 Varme artikler
Varme artikler
-
 En grøn tilgang til fremstilling af ammoniak kunne hjælpe med at brødføde verdenKredit:UCF:Karen Norum Et UCF-forskerhold med samarbejdspartnere ved Virginia Tech har udviklet en ny grøn tilgang til fremstilling af ammoniak, der kan hjælpe med at gøre fodring af den stigende
En grøn tilgang til fremstilling af ammoniak kunne hjælpe med at brødføde verdenKredit:UCF:Karen Norum Et UCF-forskerhold med samarbejdspartnere ved Virginia Tech har udviklet en ny grøn tilgang til fremstilling af ammoniak, der kan hjælpe med at gøre fodring af den stigende -
 Forskere går dybt ind for at kvantificere perovskite -egenskaberForskere ledet af Los Alamos National Laboratory og Rice University har oprettet en generel skaleringslov, der skal hjælpe med at justere de elektroniske egenskaber ved 2D-perovskitbaserede materialer
Forskere går dybt ind for at kvantificere perovskite -egenskaberForskere ledet af Los Alamos National Laboratory og Rice University har oprettet en generel skaleringslov, der skal hjælpe med at justere de elektroniske egenskaber ved 2D-perovskitbaserede materialer -
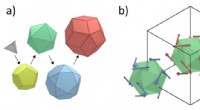 Kvasikrystalklar:Materiale afslører en unik forskydende overfladestruktur under mikroskopTsai-typen klynger sig inde i den anden af Au-Al-Tb tilnærmelsesvis videnskabsmændene valgte (a), og den tilsvarende spin -icosahedra (b). Kredit:Ryuji Tamura fra Tokyo University of Science Mel
Kvasikrystalklar:Materiale afslører en unik forskydende overfladestruktur under mikroskopTsai-typen klynger sig inde i den anden af Au-Al-Tb tilnærmelsesvis videnskabsmændene valgte (a), og den tilsvarende spin -icosahedra (b). Kredit:Ryuji Tamura fra Tokyo University of Science Mel -
 Strategien foreslår måder at forberede sig på nye antibiotika-resistente superbugsBakterier udplades i petriskåle i Gautam Dantas laboratorium på Washington University School of Medicine i St. Louis. Dantas og hans kolleger har identificeret forbindelser, der blokerer resistens ove
Strategien foreslår måder at forberede sig på nye antibiotika-resistente superbugsBakterier udplades i petriskåle i Gautam Dantas laboratorium på Washington University School of Medicine i St. Louis. Dantas og hans kolleger har identificeret forbindelser, der blokerer resistens ove
- Hvad er rækkefølgen af reaktion, for hvilken enhedshastighed og konstant det samme?
- Forsikringsselskaber:Vil du stjæle dine konkurrenters kunder?
- Hvordan Europas CHEOPS-satellit vil forbedre jagten på exoplaneter
- Hvad skete der med Androgynous?
- Hvad er det rum, der udøver kraft på objekter?
- Mineraler kan danne dybt inde i Jordens skorpe ved?


