Hybrid orbitaler brugt af klor i CLF5?
1. Lewis Structure
* Chlor er det centrale atom, omgivet af fem fluoratomer.
* Chlor har 7 valenselektroner, og hver fluor har 7.
* For at tilfredsstille oktetreglen danner klor fem enkeltbindinger med fluor, hvilket efterlader et ensomt par på klor.
2. Electron Domain Geometry
* Elektrondomæner: Chlor har 6 elektrondomæner:5 bindingsdomæner og 1 ensomme par.
* Elektrondomæne Geometri: Baseret på de 6 elektrondomæner er elektrondomængeometrien octahedral.
3. Molekylær geometri
* ensom par Effekt: Det ensomme par på klor vil forvrænge formen lidt, hvilket resulterer i en firkantet pyramidal molekylær geometri.
4. Hybridisering
* Antal hybrid orbitaler: Da der er 6 elektrondomæner, har chlorbehov 6 hybrid orbitaler.
* Hybridiseringstype: Den hybridisering, der producerer 6 orbitaler, er sp³d² (Én S, tre P og to D Orbitals).
Konklusion
Chlor i CLF5 bruger sp³d² hybrid orbitaler At danne de fem bindinger med fluor og rumme det ensomme par.
Sidste artikelFor at navngive den sammensatte skrevne som cuo ville du skrive?
Næste artikelHvor mange hydrogenatomer er der i 4H2O?
 Varme artikler
Varme artikler
-
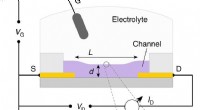 Ny metode benchmarks organiske blandede ledereOECT beskrivelse og betjening. et OECT -tværsnit, ledninger, og dimensioner:kanallængde (L), og tykkelse (d). Kilden, dræne, og port (S, D, G, henholdsvis), og relevante spændinger (gate, afløbsspændi
Ny metode benchmarks organiske blandede ledereOECT beskrivelse og betjening. et OECT -tværsnit, ledninger, og dimensioner:kanallængde (L), og tykkelse (d). Kilden, dræne, og port (S, D, G, henholdsvis), og relevante spændinger (gate, afløbsspændi -
 Fysikere får ny indsigt i nanosystemer med sfærisk indeslutningBipolær struktur samlet af stive polymerer ved lave tætheder. Kredit:Arash Nikoubashman, Mainz Universitet Teoretiske fysikere ledet af professor Kurt Binder og Dr. Arash Nikoubashman ved Johannes
Fysikere får ny indsigt i nanosystemer med sfærisk indeslutningBipolær struktur samlet af stive polymerer ved lave tætheder. Kredit:Arash Nikoubashman, Mainz Universitet Teoretiske fysikere ledet af professor Kurt Binder og Dr. Arash Nikoubashman ved Johannes -
 Nyt AI-værktøj beregner materialespænding og -belastning baseret på fotosMIT-forskere har udviklet en maskinlæringsteknik, der bruger et billede af materialets indre struktur til at estimere de spændinger og belastninger, der virker på materialet. Kredit:Massachusetts Inst
Nyt AI-værktøj beregner materialespænding og -belastning baseret på fotosMIT-forskere har udviklet en maskinlæringsteknik, der bruger et billede af materialets indre struktur til at estimere de spændinger og belastninger, der virker på materialet. Kredit:Massachusetts Inst -
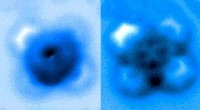 Team måler opdelingen af en enkelt kemisk bindingForskere målte de mekaniske kræfter, der blev anvendt til at bryde en binding mellem kulilte og jernphthalocyanin, som fremstår som et symmetrisk kryds i scanning probe mikroskopbilleder taget før og
Team måler opdelingen af en enkelt kemisk bindingForskere målte de mekaniske kræfter, der blev anvendt til at bryde en binding mellem kulilte og jernphthalocyanin, som fremstår som et symmetrisk kryds i scanning probe mikroskopbilleder taget før og
- Hvordan forklarer du forudgående knwledge i et videnskabeligt eksperiment?
- Hvad er den energi, der bæres af hver enhed af en strøm, der kaldes?
- Hvad er mineraler lavet af?
- Studie:At bo i udlandet fører til en klarere selvfølelse
- Hvilken sky er lav stor hvid og grå med kugleformede masser ruller?
- Er Mars den tredje planetform sol?


