Hydrogenbindinger er svagere end bindingen, der holder brint til ilt i et vandmolekyle?
Her er en sammenbrud:
* Bindingen, der holder brint til ilt i et vandmolekyle, er en kovalent binding. Dette er en stærk binding dannet ved deling af elektroner mellem brint- og iltatomer.
* hydrogenbindinger er intermolekylære bindinger. Dette betyder, at de forekommer mellem forskellige molekyler, ikke inden for det samme molekyle. De dannes på grund af tiltrækningen mellem et lidt positivt hydrogenatom i et molekyle og et lidt negativt iltatom i et andet molekyle.
Kortfattet:
* kovalente bindinger (inden for vandmolekylet) er stærkere end brintbindinger (mellem vandmolekyler).
Denne forskel i styrke er grunden til, at vandmolekyler er i stand til at danne flydende tilstande ved relativt høje temperaturer, selvom de individuelle kovalente bindinger er ret stærke. Hydrogenbindingerne kan bryde og reformere relativt let, så vandmolekylerne kan bevæge sig frit.
Sidste artikelHvilken forbindelse bruges til at kontrollere jordens syre?
Næste artikelHvilken kemisk binding mellem to bromatomer?
 Varme artikler
Varme artikler
-
 Ildfluer kaster lys over mitokondriernes funktionKredit:CC0 Public Domain Små fabrikker flyder inde i vores celler og giver dem næsten al den energi, de har brug for:mitokondrierne. Deres effektivitet falder, når vi bliver ældre, men også når vi
Ildfluer kaster lys over mitokondriernes funktionKredit:CC0 Public Domain Små fabrikker flyder inde i vores celler og giver dem næsten al den energi, de har brug for:mitokondrierne. Deres effektivitet falder, når vi bliver ældre, men også når vi -
 Kobberkatalyseret enantioselektiv trifluormethylering af benzylradikaler udvikletKredit:CC0 Public Domain Forskere fra Shanghai Institute of Organic Chemistry ved det kinesiske videnskabsakademi (CAS) har udviklet den første kobberkatalyserede enantioselektive trifluormethyler
Kobberkatalyseret enantioselektiv trifluormethylering af benzylradikaler udvikletKredit:CC0 Public Domain Forskere fra Shanghai Institute of Organic Chemistry ved det kinesiske videnskabsakademi (CAS) har udviklet den første kobberkatalyserede enantioselektive trifluormethyler -
 Gør en almindelig plast til molekyler af høj værdiEn simpel one-pot proces gør polyethylenplastaffald til værdifulde væsker, når det udsættes for en fast kemisk katalysator og lidt varme. Kredit:Fan Zhang, UCSB, CC BY-SA Hvis du troede, at de spi
Gør en almindelig plast til molekyler af høj værdiEn simpel one-pot proces gør polyethylenplastaffald til værdifulde væsker, når det udsættes for en fast kemisk katalysator og lidt varme. Kredit:Fan Zhang, UCSB, CC BY-SA Hvis du troede, at de spi -
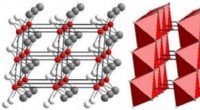 Mineralopdagelse gjort nemmere:Røntgenteknik kaster nyt lys på bittesmå, sjældne krystallerDisse diagrammer viser atomkrystalstrukturen af ognitit. Til venstre, atomer i den krystallinske struktur er repræsenteret i rødt (nikkel), hvid (tellur), og grå (vismut). Til højre, en polyhedral r
Mineralopdagelse gjort nemmere:Røntgenteknik kaster nyt lys på bittesmå, sjældne krystallerDisse diagrammer viser atomkrystalstrukturen af ognitit. Til venstre, atomer i den krystallinske struktur er repræsenteret i rødt (nikkel), hvid (tellur), og grå (vismut). Til højre, en polyhedral r
- Hvor mange millogrammer i et pund?
- Anti-kræftlægemiddel brygget fra omprogrammeret gær
- Hvordan blev Jupiter navngivet?
- Menneskelige aktiviteter forværrer luftkvaliteten i Dunhuang, et ørkenbassin i Kina
- Tesla -aktier tumler, efter at Musk -interview har givet ny frygt
- Hvad er den første ioniseringsenergi af svovl?


