Hvis 100 g CUS og 56 O2 er tilgængelige, som er den begrænsende reaktant?
1. Skriv den afbalancerede kemiske ligning:
2 cus + 3 o₂ → 2 cuo + 2 so₂
2. Konverter gram af reaktanter til mol:
* cus:
* Molmasse Cus =63,5 g/mol (Cu) + 32,1 g/mol (s) =95,6 g/mol
* Mol Cus =100 g / 95,6 g / mol =1,046 mol
* o₂:
* Molmasse O₂ =2 * 16 g/mol =32 g/mol
* Mol O₂ =56 g / 32 g / mol =1,75 mol
3. Bestem molforholdet mellem reaktanter:
Den afbalancerede ligning viser, at 2 mol Cus reagerer med 3 mol O₂.
4. Beregn molen af O₂, der er nødvendig for at reagere fuldstændigt med den tilgængelige CUS:
* Mol O₂ nødvendigt =(1,046 mol cus) * (3 mol O₂ / 2 mol Cus) =1,569 mol O₂
5. Sammenlign den beregnede O₂, der er nødvendig med den tilgængelige O₂:
* Vi har brug for 1.569 mol O₂, men har kun 1,75 mol. Dette betyder, at vi har overskydende o₂ .
Konklusion:
Da vi har mindre o₂ end nødvendigt at reagere med alt det cus, er cus den begrænsende reaktant.
 Varme artikler
Varme artikler
-
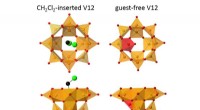 Flipped metaloxidbur kan sortere kuldioxid fra kulilteAnionstrukturer af CH 2 Cl 2 (gæst)-indsat V12 (venstre) og gæstefri V12 er vist. Orange og røde firkantede pyramider repræsenterer VO 5 enheder med deres baser rettet mod midten af skålen, og
Flipped metaloxidbur kan sortere kuldioxid fra kulilteAnionstrukturer af CH 2 Cl 2 (gæst)-indsat V12 (venstre) og gæstefri V12 er vist. Orange og røde firkantede pyramider repræsenterer VO 5 enheder med deres baser rettet mod midten af skålen, og -
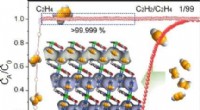 Adskillelse af sporacetylen fra ethylen i ultramikroporøse metal-organiske rammerKredit:Angewandte Chemie Ethylen, en vigtig råvare i den kemiske industri, indeholder ofte spor af acetylenforureninger, som skal fjernes. I journalen Angewandte Chemie , forskere beskriver en r
Adskillelse af sporacetylen fra ethylen i ultramikroporøse metal-organiske rammerKredit:Angewandte Chemie Ethylen, en vigtig råvare i den kemiske industri, indeholder ofte spor af acetylenforureninger, som skal fjernes. I journalen Angewandte Chemie , forskere beskriver en r -
 Dit hår ved, hvad du spiser, og hvor meget din klipning kosterKredit:Unsplash/CC0 Public Domain Millimeter for millimeter, dit hår opbygger en registrering af din kost. Da hårstrå er bygget af aminosyrer, der kommer fra din mad, de bevarer de kemiske spor af
Dit hår ved, hvad du spiser, og hvor meget din klipning kosterKredit:Unsplash/CC0 Public Domain Millimeter for millimeter, dit hår opbygger en registrering af din kost. Da hårstrå er bygget af aminosyrer, der kommer fra din mad, de bevarer de kemiske spor af -
 Katalysatorfremskridt forbedrer naturgasrensningsteknologiKatalysator flåder af palladium (Pd) oxid, der holdes sammen med enkelte atomer af platin, er effektive til at rense emissioner fra naturgasmotorer. Kredit:Cortland Johnson, PNNL. En nyudviklet ka
Katalysatorfremskridt forbedrer naturgasrensningsteknologiKatalysator flåder af palladium (Pd) oxid, der holdes sammen med enkelte atomer af platin, er effektive til at rense emissioner fra naturgasmotorer. Kredit:Cortland Johnson, PNNL. En nyudviklet ka
- Hvordan adskiller vand sig fra luften på den måde, det overfører varme på en organisme?
- Isstrøm, der dræner Grønlands indlandsis, følsom over for ændringer over de sidste 45, 000 år
- BILLEDER:Scener under midnatssolen i Arktis
- Storytelling kan reducere virtual reality-cybersyge
- Sprængning af molekyler med ekstreme røntgenstråler
- Hvad kan slanger lære os om ingeniørfriktion?


