Orientering natriumioner og chloridioner?
Sådan er de orienterede:
* kubisk struktur: Natrium- og chloridionerne arrangerer sig i et ansigt-centreret kubik (FCC) Gitter. Dette betyder, at hver ion er omgivet af seks ioner af den modsatte ladning.
* skiftende afgifter: Natriumioner og chloridioner skifter i gitteret. Dette skaber en afbalanceret, neutral ladning i hele krystallen.
* ioniske bindinger: De attraktive kræfter mellem de positivt ladede natriumioner og de negativt ladede chloridioner kaldes ioniske bindinger . Disse bindinger holder krystalstrukturen sammen.
Visualisering af strukturen:
Forestil dig en terning. I midten af hver side af terningen er der en natriumion. I midten af selve terningen er der en chloridion. Dette mønster gentages i hele krystalstrukturen.
Nøglepunkter:
* Orienteringen af natrium- og chloridioner i krystalgitteret er afgørende for stabiliteten af saltkrystallen.
* De stærke ioniske bindinger mellem ionerne giver bordsalt det høje smeltepunkt og hårdhed.
Bemærk: Mens vi taler om orienteringen af ioner i en krystal, er det vigtigt at huske, at ioner konstant vibrerer inden for gitteret. De er ikke statiske, men snarere er deres bevægelse begrænset til et specifikt, organiseret arrangement.
Sidste artikelHvilken er mere reaktiv zink eller nikkel?
Næste artikelBestem antallet af bindingselektroner og ikke -bonding i struktur CO2?
 Varme artikler
Varme artikler
-
 Genvinding af fosfor fra produktion af majsethanol kan hjælpe med at reducere grundvandsforureningVijay Singh, professor og direktør for Integrated Bioprocessing Research Lab, og Ankita Juneja, postdoktoral forskningsassistent i landbrugs- og biologisk teknik ved University of Illinois, viste, at
Genvinding af fosfor fra produktion af majsethanol kan hjælpe med at reducere grundvandsforureningVijay Singh, professor og direktør for Integrated Bioprocessing Research Lab, og Ankita Juneja, postdoktoral forskningsassistent i landbrugs- og biologisk teknik ved University of Illinois, viste, at -
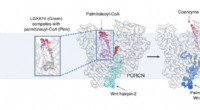 Nye cryo-EM-billeder kaster lys over Wnt-signaleringCryo-EM afslører, hvordan Wnt, et nøglesignalmolekyle for menneskelig udvikling og kræft, modificeres af et enzym ved navn PORCN. Kredit:UT Southwestern Medical Center Ved hjælp af UT Southwesterns
Nye cryo-EM-billeder kaster lys over Wnt-signaleringCryo-EM afslører, hvordan Wnt, et nøglesignalmolekyle for menneskelig udvikling og kræft, modificeres af et enzym ved navn PORCN. Kredit:UT Southwestern Medical Center Ved hjælp af UT Southwesterns -
 Nyt mikroskop sætter rekord for visualisering af overfladebefugtningsegenskaberMikroskopets dråbesonde på en superhydrofob gylden fuglevinge (Troides aeacus) sommerfuglevinge. Kredit:Matti Hokkanen / Aalto University Mikroskopet er 1000 gange mere præcist end nuværende tekni
Nyt mikroskop sætter rekord for visualisering af overfladebefugtningsegenskaberMikroskopets dråbesonde på en superhydrofob gylden fuglevinge (Troides aeacus) sommerfuglevinge. Kredit:Matti Hokkanen / Aalto University Mikroskopet er 1000 gange mere præcist end nuværende tekni -
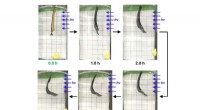 Ny molekylær muskel reagerer på synligt lysPolymeren blev fastgjort til en slip af sort elektrisk tape. Udsat for blåt lys, den kunstige molekylære muskel flyttede en vægt på 20 milligram flere centimeter fra sin startposition. Kredit:Barnes l
Ny molekylær muskel reagerer på synligt lysPolymeren blev fastgjort til en slip af sort elektrisk tape. Udsat for blåt lys, den kunstige molekylære muskel flyttede en vægt på 20 milligram flere centimeter fra sin startposition. Kredit:Barnes l
- Hvad var den vigtigste naturressource for de tidlige Texas -bosættere?
- Er elektrisk energi fra solen?
- Sådan får kønsceller den rigtige genetiske blanding:En tværfaglig tilgang løser et århundrede …
- Pinde og sten kan knække dine knogler, men denne reaktion redigerer skeletter
- Kæmpe organisk molekyle lavet af små molekyler forbundet sammen?
- Kamp eller flyvning:Ustyrige passagerer har gjort flyvning direkte skræmmende


