Hvordan dannes en brintbinding?
Her er en sammenbrud af, hvordan det sker:
1. polære kovalente obligationer: Det elektronegative atom tiltrækker kraftigt de delte elektroner i den kovalente binding med brint, hvilket skaber en delvis positiv ladning På hydrogenatomet (Δ+) og A delvis negativ ladning på det elektronegative atom (Δ-).
2. Elektrostatisk attraktion: Denne ujævne fordeling af ladning skaber et dipolmoment i molekylet. Det delvist positive hydrogenatom tiltrækkes af det delvist negative ensomme par elektroner på det nærliggende elektronegative atom i et andet molekyle.
3. Denne elektrostatiske attraktion mellem Δ+ brint og δ-elektronegativt atom danner A brintbinding - En svag, men vigtig type interaktion.
Vigtige egenskaber ved brintbindinger:
* svag, men markant: De er meget svagere end kovalente bindinger, men stærkere end van der Waals -styrker.
* retningsbestemt: De er meget retningsbestemte og dannes langs en lige linje mellem brint og det elektronegative atom.
* Vigtigt for biologiske molekyler: De spiller en afgørende rolle i at holde DNA -strenge sammen, stabilisere proteinstrukturer og lette Water's unikke egenskaber.
her er en simpel analogi: Forestil dig en magnet med en nordpol (Δ+) og en sydpol (Δ-). Nordpolen tiltrækker sydpolen af en anden magnet. Denne attraktion svarer til tiltrækningen mellem Δ+ brint og det elektronegative atom i en brintbinding.
Eksempler:
* Vand: Vandmolekyler danner hydrogenbindinger med hinanden, hvilket bidrager til dets høje kogepunkt og overfladespænding.
* DNA: Hydrogenbindinger mellem baserne af DNA -strenge holder dobbelthelixen sammen.
* Proteiner: Hydrogenbindinger hjælper med at folde og stabilisere proteinstrukturer.
Håber, at denne forklaring er nyttig!
 Varme artikler
Varme artikler
-
 Avancerede biomaterialer med silkefibroin-bioaktivt glas til at konstruere patientspecifikke 3D-knog…Udvikling af avancerede hybride biomaterialer ved hjælp af tilpasset 3D-printsoftware. Kredit:RoboCAD, 3D blæk, LLC, doi:10.1088/1748-605X/aad2a9 Den komplekse arkitektur af knogler er udfordrende
Avancerede biomaterialer med silkefibroin-bioaktivt glas til at konstruere patientspecifikke 3D-knog…Udvikling af avancerede hybride biomaterialer ved hjælp af tilpasset 3D-printsoftware. Kredit:RoboCAD, 3D blæk, LLC, doi:10.1088/1748-605X/aad2a9 Den komplekse arkitektur af knogler er udfordrende -
 Botulinum-type toksiner springer til en ny slags bakterierUdseendet af et botulinumlignende toksin i Enterococcus -en allestedsnærværende bakterie og en fremvoksende årsag til multiresistente infektioner-vækker videnskabelig bekymring. Kredit:Francois Lebr
Botulinum-type toksiner springer til en ny slags bakterierUdseendet af et botulinumlignende toksin i Enterococcus -en allestedsnærværende bakterie og en fremvoksende årsag til multiresistente infektioner-vækker videnskabelig bekymring. Kredit:Francois Lebr -
 Forskere finder, at 2-D overgangsmetalkarbider reagerer med vand, åbner en dør til deres ukendte k…MXenes reaktivitet over for vand er vist i dette eksperiment, hvor en Ti-carbid MXene overlever længere i en iltmættet, ikke-vandigt system, i modsætning til det samme MXene dispergeret i argon-mættet
Forskere finder, at 2-D overgangsmetalkarbider reagerer med vand, åbner en dør til deres ukendte k…MXenes reaktivitet over for vand er vist i dette eksperiment, hvor en Ti-carbid MXene overlever længere i en iltmættet, ikke-vandigt system, i modsætning til det samme MXene dispergeret i argon-mættet -
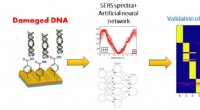 Forskere får neurale netværk til at opdage DNA-skader forårsaget af UV-strålingSkematisk diagram af SERS-sensorens drift i kombination med det neurale netværk til analyse af DNA-skader. Kredit:TPU Forskere ved Tomsk Polytekniske Universitet udførte sammen med Universitetet f
Forskere får neurale netværk til at opdage DNA-skader forårsaget af UV-strålingSkematisk diagram af SERS-sensorens drift i kombination med det neurale netværk til analyse af DNA-skader. Kredit:TPU Forskere ved Tomsk Polytekniske Universitet udførte sammen med Universitetet f
- Nikkel-skum-understøttet carbon-nanorør-elektrode giver forbedret ydeevne til lette lithium-batter…
- En ionforbindelse med en polyatomisk kation og anion Atomerne i er alle fra samme gruppe?
- Hvad er den gas, der brænder for at danne vand?
- Fælles WiFi kan registrere våben, bomber og kemikalier i poser
- Skildpadderne skyller i land i Sri Lanka efter skibets brand
- Digitale bøger skader små børns læring – medmindre bøgerne har de rette forbedringer


