Hvorfor udfører en vandig opløsning af natriumchlorid elektricitet?
1. opløsning: Når natriumchlorid (NaCl) opløses i vand, adskiller det sig i dets bestanddel ioner:natriumioner (Na+) og chloridioner (Cl-). Dette skyldes den stærke elektrostatiske tiltrækning mellem vandmolekyler og ionerne, der overvinder tiltrækningen mellem Na+ og Cl- ioner i den faste krystal.
2. ionmobilitet: Disse ioner er nu frie til at bevæge sig gennem løsningen. Når en spænding påføres på tværs af opløsningen, bevæger de positivt ladede natriumioner (Na+) sig mod den negative elektrode (katode), og de negativt ladede chloridioner (CL-) bevæger sig mod den positive elektrode (anode).
3. Elektrisk strøm: Denne bevægelse af ladede ioner udgør en elektrisk strøm. Jo flere ioner der er til stede i opløsningen, jo stærkere ledningsevnen.
I modsætning: Rent vand i sig selv er en meget dårlig leder af elektricitet, fordi det indeholder meget få frie ioner.
Key Takeaway: Tilstedeværelsen af frie ioner, skabt ved dissociering af opløsningen, er den nøglefaktor, der tillader en vandig opløsning af natriumchlorid til at udføre elektricitet.
Sidste artikelHvilke elementer laver kobber?
Næste artikelHvor mange atomer er der i 0,308 mol 13C?
 Varme artikler
Varme artikler
-
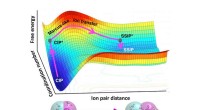 Elegant teori viser, hvordan vand hjælper med at adskille ioner involveret i materialesyntese og -f…Adskillelsen (bunden) af lithiumfluorid (Li og F) ionpar involverer to trin:(1) en forøgelse af vandkoordinationen omkring ionerne (kontaktionpar, CIP til CIP*) og (2) rumlig adskillelse af ionerne (C
Elegant teori viser, hvordan vand hjælper med at adskille ioner involveret i materialesyntese og -f…Adskillelsen (bunden) af lithiumfluorid (Li og F) ionpar involverer to trin:(1) en forøgelse af vandkoordinationen omkring ionerne (kontaktionpar, CIP til CIP*) og (2) rumlig adskillelse af ionerne (C -
 Germanium lover bedre opto-elektroniske egenskaber end tin til kesterit solcellerBilledet viser det typiske arrangement af kationer i en struktur af kesterit. I baggrunden er krystalstrukturen vist, en enhedscelle fremhæves. Kredit:HZB Specifikke ændringer i sammensætningen af
Germanium lover bedre opto-elektroniske egenskaber end tin til kesterit solcellerBilledet viser det typiske arrangement af kationer i en struktur af kesterit. I baggrunden er krystalstrukturen vist, en enhedscelle fremhæves. Kredit:HZB Specifikke ændringer i sammensætningen af -
 Turboladning af brændselsceller med en multifunktionel katalysatorEt nyt boost til brændselscelleteknologi fra Georgia Tech:En nanopartikelbelægning på denne disk turbolader forarbejdning af ilt på katodeenden af faste oxidbrændselsceller, øger den otte gange nuvæ
Turboladning af brændselsceller med en multifunktionel katalysatorEt nyt boost til brændselscelleteknologi fra Georgia Tech:En nanopartikelbelægning på denne disk turbolader forarbejdning af ilt på katodeenden af faste oxidbrændselsceller, øger den otte gange nuvæ -
 En videnskabelig metode til perfekt fondueKredit:American Chemical Society Ostefondue er et ikon for det schweiziske køkken og et hovedprodukt til middagsselskab. Selvom det kan virke som en simpel ret, at få den rigtige tekstur kan være
En videnskabelig metode til perfekt fondueKredit:American Chemical Society Ostefondue er et ikon for det schweiziske køkken og et hovedprodukt til middagsselskab. Selvom det kan virke som en simpel ret, at få den rigtige tekstur kan være


