Hvad gør natriumatom forskellig fra magnesium?
1. Atomnummer og elektronkonfiguration:
* natrium (NA) Har et atomnummer på 11, hvilket betyder, at det har 11 protoner og 11 elektroner. Dens elektronkonfiguration er 2, 8, 1.
* magnesium (mg) Har et atomnummer på 12, hvilket betyder, at det har 12 protoner og 12 elektroner. Dens elektronkonfiguration er 2, 8, 2.
2. Antal valenselektroner:
* natrium har en Valenselektron i dets yderste skal.
* magnesium har to Valenselektroner i sin yderste skal.
3. Reaktivitet:
* natrium er meget reaktiv på grund af dets enkelte valenselektron, som det let mister for at danne en +1 ion. Det reagerer kraftigt med vand og luft.
* magnesium er mindre reaktiv end natrium, fordi det har brug for at miste to valenselektroner for at opnå stabilitet. Det er også mindre reaktivt end natrium med vand og luft.
4. Fysiske egenskaber:
* natrium er et blødt, sølvhvid metal.
* magnesium er et sølvfarvet, stærkt og let metal.
5. Kemiske egenskaber:
* natrium Formularer ioniske forbindelser med ikke-metaler, der let mister sin valenselektron for at opnå en stabil oktet.
* magnesium Former også ioniske forbindelser, men det kræver mere energi for at miste sine to valenselektroner.
6. Anvendelser:
* natrium bruges i forskellige anvendelser, herunder produktion af natriumhydroxid (NaOH), natriumchlorid (NaCl) og natriumcarbonat (Na2CO3).
* magnesium bruges i legeringer, fyrværkeri og som et reduktionsmiddel i kemiske reaktioner.
Kortfattet: Natrium og magnesium adskiller sig i deres atomstruktur, reaktivitet, fysiske egenskaber, kemiske egenskaber og anvendelser. Disse forskelle opstår fra det varierende antal valenselektroner og deres tilknyttede elektronkonfigurationer.
Sidste artikelHvor mange atomer laver 1 gram jern?
Næste artikelForklar hvorfor acetylchlorid hydrolyseres hurtigere end benzoylchlorid?
 Varme artikler
Varme artikler
-
 Mærkning af en bakteriecellejakke:Team opfinder en videnskabelig metode til at spore celler implice…Immunsystemets forskningsteam:Fra venstre Prof. Catherine Grimes, doktorander Hai Liang og Ching-Wen (Sandy) Hou, Jeff Caplan, direktør for Bio-Imaging Center, ph.d.-studerende Kristen DeMeester og pr
Mærkning af en bakteriecellejakke:Team opfinder en videnskabelig metode til at spore celler implice…Immunsystemets forskningsteam:Fra venstre Prof. Catherine Grimes, doktorander Hai Liang og Ching-Wen (Sandy) Hou, Jeff Caplan, direktør for Bio-Imaging Center, ph.d.-studerende Kristen DeMeester og pr -
 Vandopdeling til konvertering af solenergiPt-modificerede BaTaO2N fotokatalysatorer. Kredit:Citeret fra Wang, Z., Luo, Y., Hisatomi, T. et al. Sekventiel cokatalysatordekoration på BaTaO2N mod højaktiv Z-skema vandspaltning. Nat Commun 12, 10
Vandopdeling til konvertering af solenergiPt-modificerede BaTaO2N fotokatalysatorer. Kredit:Citeret fra Wang, Z., Luo, Y., Hisatomi, T. et al. Sekventiel cokatalysatordekoration på BaTaO2N mod højaktiv Z-skema vandspaltning. Nat Commun 12, 10 -
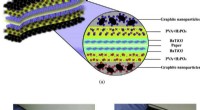 Formen på de kommende ting:Fleksibel, foldbare superkondensatorer til energilagring(a) skematisk af den symmetriske papirsuperkondensator med strukturen af GNPs elektroder (b) billede af den fremstillede superkondensator (c) billede af papirsuperkondensator i bøjetilstand. Kredit:
Formen på de kommende ting:Fleksibel, foldbare superkondensatorer til energilagring(a) skematisk af den symmetriske papirsuperkondensator med strukturen af GNPs elektroder (b) billede af den fremstillede superkondensator (c) billede af papirsuperkondensator i bøjetilstand. Kredit: -
 Svamp som lyddæmper3D-udskrivning af en prøve baseret på mycelium. Kredit:Fraunhofer UMSICHT Så sund og velsmagende som svampe kan være, de er gode til meget mere end bare middagsfadet. Fraunhofer Institut for Miljø
Svamp som lyddæmper3D-udskrivning af en prøve baseret på mycelium. Kredit:Fraunhofer UMSICHT Så sund og velsmagende som svampe kan være, de er gode til meget mere end bare middagsfadet. Fraunhofer Institut for Miljø
- Sådan fungerer obduktioner
- Safran – hvordan man skelner den ægte vare fra en falsk
- Ingeniører fremmer mulighederne for bærbar teknologi
- Hvad er der i dit vand? Forskere identificerer nye giftige biprodukter ved desinficering af drikkeva…
- Hvordan cykler nitrogen gennem økosystemet?
- Stip af fossildannelse


