Forklar hvorfor acetylchlorid hydrolyseres hurtigere end benzoylchlorid?
1. Elektroniske effekter:
* induktiv effekt: Methylgruppen i acetylchlorid er elektron-donerende, hvilket øger elektrondensiteten på carbonylcarbon, hvilket gør det mere modtageligt for nukleofilt angreb ved vand. I modsætning hertil er phenylgruppen i benzoylchlorid elektronisk tilbagetrækning på grund af resonans, hvilket reducerer elektrondensiteten på carbonylcarbonet og gør det mindre reaktivt.
* Resonanseffekt: Phenylringen i benzoylchlorid kan delokalisere den positive ladning på carbonylcarbonet gennem resonans, hvilket gør carbonylgruppen mindre elektrofil. Denne resonansstabilisering er fraværende i acetylchlorid.
2. Steriske effekter:
* Methylgruppen i acetylchlorid er mindre end phenylgruppen i benzoylchlorid. Denne mindre størrelse tillader vandmolekyler at nærme sig carbonylcarbon lettere og angribe den, hvilket fører til hurtigere hydrolyse.
3. Opløsningsmiddeleffekter:
* Hydrolyse er en nukleofil reaktion, der favoriseres i polære opløsningsmidler som vand. Den polære carbonylgruppe i acetylchlorid er mere tilgængelig for vandmolekyler på grund af den mindre methylgruppe, hvilket gør den mere modtagelig for hydrolyse.
Generelt forklarer kombinationen af elektroniske, steriske og opløsningsmiddeleffekter, hvorfor acetylchlorid gennemgår hydrolyse hurtigere end benzoylchlorid.
Kortfattet:
* Acetylchlorid er mere reaktiv på grund af dets elektron-donerende methylgruppe og mangel på resonansstabilisering.
* Benzoylchlorid er mindre reaktiv på grund af dets elektronoptagende phenylgruppe og resonansstabilisering.
* Sterisk hindring fra phenylgruppen gør det sværere for vandmolekyler at nærme sig carbonylcarbonet i benzoylchlorid.
Disse faktorer bidrager kollektivt til hurtigere hydrolyse af acetylchlorid sammenlignet med benzoylchlorid.
 Varme artikler
Varme artikler
-
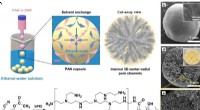 Ny teknologi øger dramatisk genindvindingsgraden af ædle metaller fra affaldFremstillingsprocessen og de fysiske/kemiske strukturer af guldgenvindingsmateriale. Kredit:Korea Institute of Science and Technology (KIST) I Sydkorea, som er afhængig af import for 99,3 % af sine
Ny teknologi øger dramatisk genindvindingsgraden af ædle metaller fra affaldFremstillingsprocessen og de fysiske/kemiske strukturer af guldgenvindingsmateriale. Kredit:Korea Institute of Science and Technology (KIST) I Sydkorea, som er afhængig af import for 99,3 % af sine -
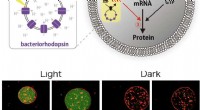 Forskeren konstruerer kunstige fotosyntetiske cellerSkemaer af den kunstige fotosyntetiske celle, der indkapsler kunstig organel, består af ATP -syntase og bakteriorhodopsin. Den kunstige organel syntetiserer ATP ved let belysning. Den fotosyntetisered
Forskeren konstruerer kunstige fotosyntetiske cellerSkemaer af den kunstige fotosyntetiske celle, der indkapsler kunstig organel, består af ATP -syntase og bakteriorhodopsin. Den kunstige organel syntetiserer ATP ved let belysning. Den fotosyntetisered -
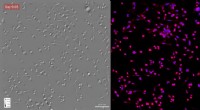 Ny metode bruger kunstig intelligens til at studere levende cellerTime-lapse gradient lysinterferensmikroskopi, eller GLIM, venstre, og fasebilleddannelse med beregningsspecificitet afbildet over syv dage. Kredit:Beckman Institute for Advanced Science and Technology
Ny metode bruger kunstig intelligens til at studere levende cellerTime-lapse gradient lysinterferensmikroskopi, eller GLIM, venstre, og fasebilleddannelse med beregningsspecificitet afbildet over syv dage. Kredit:Beckman Institute for Advanced Science and Technology -
 Nye materialer:En vippekontakt til katalyseEn perovskit tyndfilm elektrode, på en ZrO2-krystal. Kredit:TU Wien Elektrokemi spiller en stadig vigtigere rolle:Uanset om det er brændselsceller, elektrolyse eller kemisk energilagring, kemiske
Nye materialer:En vippekontakt til katalyseEn perovskit tyndfilm elektrode, på en ZrO2-krystal. Kredit:TU Wien Elektrokemi spiller en stadig vigtigere rolle:Uanset om det er brændselsceller, elektrolyse eller kemisk energilagring, kemiske
- Ekstremt mørke:Carbon nanorørskov dækker NISTs ultramørke detektor
- Hvordan hjælper reduktion af ressourcer miljøet?
- Hvilke af følgende principper er involveret, når du ser et gennemsigtigt objekt i klar væske?
- Kan forbedre marginaliserede unges selvtillid? Forsker samarbejder med Second City teater for at fin…
- Jordens fedt:estimering af de økologiske omkostninger ved overspisning
- HBr er en stærkere syre end HCl?


