Hvorfor har svovldioxid lavt kogepunkt?
* svage intermolekylære kræfter: SO₂-molekyler holdes sammen af relativt svage van der Waals-kræfter, specifikt dipol-dipolinteraktioner. Dette skyldes, at molekylet har en bøjet form, hvilket skaber et permanent dipolmoment. Imidlertid er disse kræfter svagere end hydrogenbinding eller stærke dipol-dipol-interaktioner, der findes i nogle andre molekyler.
* lille molekylær størrelse: SO₂ har en relativt lille molekylær størrelse, hvilket reducerer det overfladeareal, der er tilgængeligt for intermolekylære interaktioner. Dette fører til svagere samlede attraktioner mellem molekyler.
* lav molekylvægt: Den lave molekylvægt af SO₂ (64 g/mol) bidrager også til dets lave kogepunkt. Lysere molekyler har en tendens til at have lavere kogepunkter, fordi de kræver mindre energi for at overvinde de intermolekylære kræfter og komme ind i den gasformige tilstand.
I modsætning til andre molekyler:
* Molekyler med stærk hydrogenbinding, som vand, har markant højere kogepunkter, fordi disse bindinger er meget stærkere end van der Waals -styrker.
* Større molekyler med mere overfladeareal, såsom kulbrinter, har også højere kogepunkter på grund af øgede van der Waals -interaktioner.
Kortfattet: Kombinationen af svage intermolekylære kræfter, lille molekylær størrelse og lav molekylvægt bidrager alle til det relativt lave kogepunkt af svovldioxid.
 Varme artikler
Varme artikler
-
 Nyt værktøj kunne behandle blodinfektioner hurtigtKredit:CC0 Public Domain Blodbaneinfektioner er notorisk dødelige. Ikke fordi de ikke kan behandles, men fordi de arbejder hurtigt og er svære at diagnosticere. For at finde ud af, hvilken medicin
Nyt værktøj kunne behandle blodinfektioner hurtigtKredit:CC0 Public Domain Blodbaneinfektioner er notorisk dødelige. Ikke fordi de ikke kan behandles, men fordi de arbejder hurtigt og er svære at diagnosticere. For at finde ud af, hvilken medicin -
 Forskere udvikler fagocytiske protoceller, der er i stand til målrettet levering af enzymerTidssekvens af optiske mikroskopibilleder, der viser spontan overførsel af et farvestoffyldt tværbundet silicakolloidsom (rød genstand, stiplet linje) ind i en magnetisk emulsionsdråbe gennem en fedts
Forskere udvikler fagocytiske protoceller, der er i stand til målrettet levering af enzymerTidssekvens af optiske mikroskopibilleder, der viser spontan overførsel af et farvestoffyldt tværbundet silicakolloidsom (rød genstand, stiplet linje) ind i en magnetisk emulsionsdråbe gennem en fedts -
 Beregningskemi understøtter forskning i nye halvlederteknologierKunstnerens gengivelse af organiske molekyler, der adsorberer på en siliciumoverflade. Kredit:Aaron Beller Efterhånden som nye metoder er blevet tilgængelige til at forstå og manipulere stof på de
Beregningskemi understøtter forskning i nye halvlederteknologierKunstnerens gengivelse af organiske molekyler, der adsorberer på en siliciumoverflade. Kredit:Aaron Beller Efterhånden som nye metoder er blevet tilgængelige til at forstå og manipulere stof på de -
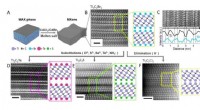 En ny strategi til syntetisering af 2-D uorganiske materialer, der bruges i kondensatorer, batterier…Overfladereaktioner af MXener i smeltede uorganiske salte. (A) Skemaer for ætsning af MAX faser i Lewis sure smeltede salte. (B) Atomisk opløsning højvinklet ringformet mørkt felt (HAADF) billede af T
En ny strategi til syntetisering af 2-D uorganiske materialer, der bruges i kondensatorer, batterier…Overfladereaktioner af MXener i smeltede uorganiske salte. (A) Skemaer for ætsning af MAX faser i Lewis sure smeltede salte. (B) Atomisk opløsning højvinklet ringformet mørkt felt (HAADF) billede af T
- Forsinket internetprojekt i Kentucky står over for et nyt egern -tilbageslag
- Fosforforurening når farlige niveauer på verdensplan, ny undersøgelse finder
- Hvilken af følgende reaktioner viser, at dannelse SO2 frigiver 296,8 kJ mol?
- Hvad er den generelle ligning for en syre-base reaktion?
- Qualcomm siger, at tidligere formand undersøger buyout -indsats
- Er det en kemisk reaktion, hvis du men kobber i ild og bliver sort?


