Hvorfor kan ikke NaCl udføre elektricitet i solid form?
* ionisk struktur: NaCl består af et regelmæssigt arrangement af positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-) holdt sammen af stærke elektrostatiske kræfter. Disse ioner er fikseret i deres positioner inden for krystalgitteret.
* Ingen gratis opladningsbærere: I fast tilstand er ionerne tæt bundet og kan ikke bevæge sig frit. Dette betyder, at der ikke er nogen frie elektroner eller ioner til at bære en elektrisk strøm.
* ledning i væske eller opløsning: Når NaCl opløses i vand eller smelter, bliver ionerne frie til at bevæge sig rundt. Dette giver mulighed for strøm af elektrisk strøm, da de ladede ioner nu kan fungere som ladningsbærere.
Kortfattet:
* solid NaCl: Rettede ioner, ingen gratis ladningsbærere, ingen elektricitetsledning.
* væske eller opløsning: Gratis ioner, til stede opladningsbærere, elektricitetsledning.
Sidste artikelHvad er navnet på en forbindelse lavet af jern- og iltatomer?
Næste artikelHvad er den strukturelle formel for brintgas?
 Varme artikler
Varme artikler
-
 Forskere skaber nye materialer, der kan øge stabiliteten af perovskit-solcellerTværbindingseffekt giver modstand mod de nye forbindelser syntetiseret af litauiske kemikere. Kredit:And Unicorns En gruppe kemikere fra Kaunas University of Technology i Litauen, udviklerne af ads
Forskere skaber nye materialer, der kan øge stabiliteten af perovskit-solcellerTværbindingseffekt giver modstand mod de nye forbindelser syntetiseret af litauiske kemikere. Kredit:And Unicorns En gruppe kemikere fra Kaunas University of Technology i Litauen, udviklerne af ads -
 Ignorerende store tavse gener lader bakterier producere nye molekyler, potentielle lægemiddelkandid…Illinois -forskere udviklede en teknik til at deaktivere tavse gener i Streptomyces -bakterier ved hjælp af lokke -DNA -fragmenter for at lokke repressorer væk. På billedet, fra venstre:postdoktor Fan
Ignorerende store tavse gener lader bakterier producere nye molekyler, potentielle lægemiddelkandid…Illinois -forskere udviklede en teknik til at deaktivere tavse gener i Streptomyces -bakterier ved hjælp af lokke -DNA -fragmenter for at lokke repressorer væk. På billedet, fra venstre:postdoktor Fan -
 Brug af matematik til at forudsige SARS-CoV-2-proteinmutationerEt team af forskere brugte matematik til at forudsige, hvilke områder af SARS-CoV-2 spike-proteinet der er mest tilbøjelige til at mutere. Kredit:Jill Hemman/ORNL, U.S.A. Dept. of Energy Oak Ridge
Brug af matematik til at forudsige SARS-CoV-2-proteinmutationerEt team af forskere brugte matematik til at forudsige, hvilke områder af SARS-CoV-2 spike-proteinet der er mest tilbøjelige til at mutere. Kredit:Jill Hemman/ORNL, U.S.A. Dept. of Energy Oak Ridge -
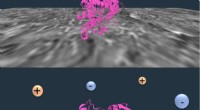 Salt hjælper proteiner med at komme videre hen ad vejenRice University-forskere fandt ud af, at adsorption af transferrin til nylongrænsefladen i kromatografi (øverst) inducerer den delvise udfoldning af proteinet (nederst). Denne udfoldelse forstærkes i
Salt hjælper proteiner med at komme videre hen ad vejenRice University-forskere fandt ud af, at adsorption af transferrin til nylongrænsefladen i kromatografi (øverst) inducerer den delvise udfoldning af proteinet (nederst). Denne udfoldelse forstærkes i
- Hvor mange hæmmolekyler er fastgjort til en polypeptidkæde?
- Hvilket udstyr brugte Albert Einstein?
- Hvad er hastigheden på en bølge, der har bølgelængde 60. Meter og frekvens af 6,0 Hertz?
- Bredt spektralområde få-cyklus laserpulser karakterisering ved hjælp af en FASI-enhed
- Folk overvurderer sorte amerikaneres chancer for økonomisk succes
- Netværk bliver kvantum


