En 2,14 g prøve af natriumhypoiodit opløses i vand for at fremstille 1,25 L opløsning pH 11.32 Hvad Kb for ion?
1. Forstå kemi
* natriumhypoiodit (naio) er et salt, der opløses i vand til at producere natriumioner (Na+) og hypoioditioner (IO-).
* hypoioditioner (IO-) er den konjugerede base af hypoiodous syre (HIO). De kan reagere med vand i en ligevægtsreaktion for at producere hydroxidioner (OH-):
`` `
Io- (aq) + h2o (l) ⇌ hio (aq) + OH- (aq)
`` `
* kb er basisdissocieringen konstant for denne ligevægt. En højere KB -værdi indikerer en stærkere base.
2. Opret isbordet
Vi bruger en is (indledende, ændring, ligevægt) -tabel til at finde ligevægtskoncentrationerne:
| | Io- | Hio | Åh- |
| ------------- | --------- | --------- | --------- |
| Indledende | X | 0 | 0 |
| Ændring | -y | +y | +y |
| Ligevægt | x - y | y | y |
* x er den indledende koncentration af io-
* y er ændringen i koncentration ved ligevægt
3. Beregn den indledende koncentration af IO-
* molmasse naio: 149,89 g/mol
* mol naio: (2,14 g) / (149,89 g / mol) =0,0143 mol
* indledende koncentration af IO-: (0,0143 mol) / (1,25 l) =0,0114 m
4. Beregn hydroxidionkoncentrationen
* ph + POH =14
* POH =14 - 11.32 =2,68
* [oh-] =10^-2,68 =2,1 x 10^-3 m
5. Brug ligevægtskoncentrationerne til at finde KB
* [oh-] =y =2,1 x 10^-3 m
* [Hio] =y =2,1 x 10^-3 m
* [io-] =x - y =0,0114 m - 2,1 x 10^-3 m =0,0093 m
kb =([hio] [oh-]) / [io-]
kb =(2,1 x 10^-3 m) (2,1 x 10^-3 m) / (0,0093 m)
kb =4,7 x 10^-4
Derfor er KB for hypoiodition (IO-) ca. 4,7 x 10^-4.
 Varme artikler
Varme artikler
-
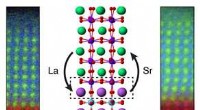 Udnyttelse af tabte atomer kan hjælpe med at skabe nye, aldrig før sete oxiderKemisk kortlægning og illustration af atomare omlejring ved grænsefladen mellem to oxidmaterialer (La =lanthan; Sr =strontium). Kredit:PNNL At forstå, hvordan materialer dannes og kombineres med h
Udnyttelse af tabte atomer kan hjælpe med at skabe nye, aldrig før sete oxiderKemisk kortlægning og illustration af atomare omlejring ved grænsefladen mellem to oxidmaterialer (La =lanthan; Sr =strontium). Kredit:PNNL At forstå, hvordan materialer dannes og kombineres med h -
 De lysaktive biomolekylers mange strukturerI sin doktorafhandling, Tufa Assafa låser op for lysfølsomme biomolekylers hemmeligheder. Kredit:RUB, Kramer Hvordan den lysfølsomme del af biomolekylet phytochrom ændrer sig fra en lys-tilpasset
De lysaktive biomolekylers mange strukturerI sin doktorafhandling, Tufa Assafa låser op for lysfølsomme biomolekylers hemmeligheder. Kredit:RUB, Kramer Hvordan den lysfølsomme del af biomolekylet phytochrom ændrer sig fra en lys-tilpasset -
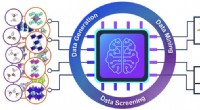 Datavidenskab hjælper ingeniører med at opdage nye materialer til solceller og LED'erSkematisk illustration af arbejdsgangen for high-throughput design af organisk-uorganisk hybrid halogenid-halvledere til solceller og lysdioder. Kredit:Yang lab/Energy &Environmental Science Ingen
Datavidenskab hjælper ingeniører med at opdage nye materialer til solceller og LED'erSkematisk illustration af arbejdsgangen for high-throughput design af organisk-uorganisk hybrid halogenid-halvledere til solceller og lysdioder. Kredit:Yang lab/Energy &Environmental Science Ingen -
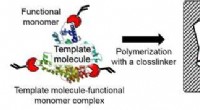 Meget følsom metode til at opdage potentiel cancerbiomarkørFigur 2:Koncept for molekylær prægningsteknologi. Kredit:Kobe University Exosomer regulerer intercellulær kommunikation i kræftformer, og henleder opmærksomheden som en potentiel kræftbiomarkør. E
Meget følsom metode til at opdage potentiel cancerbiomarkørFigur 2:Koncept for molekylær prægningsteknologi. Kredit:Kobe University Exosomer regulerer intercellulær kommunikation i kræftformer, og henleder opmærksomheden som en potentiel kræftbiomarkør. E
- Sektor for tidlige år i Storbritannien har brug for ny strategi for at rekruttere og støtte mandli…
- Mystiske cellulære dråber kommer i fokus
- Mikroskop ved hjælp af UV i stedet for synligt lys, der dukker op som diagnostisk værktøj
- En flydende genstand svinger op og ned 2 komplette cyklusser på 1 sekund som en vandbølge af bølg…
- Hvad er varigheden af A Walk on Moon?
- Hvordan beregnes accelerationen af et objekt, der bevæger sig i en ret linje?


