Hvorfor har klor et højere kogepunkt end Krypton?
1. Intermolekylære kræfter:
* klor (cl₂): Klormolekyler er ikke -polære, men har London -spredningskræfter , som er svage midlertidige attraktioner forårsaget af midlertidige udsving i elektronfordeling. Disse kræfter er stærkere i klor på grund af dens større elektronsky og højere polariserbarhed.
* krypton (KR): Krypton er en ædel gas og eksisterer som individuelle atomer med kun svage London -spredningskræfter. Disse kræfter er svagere i Krypton, fordi det er et mindre atom med færre elektroner.
2. Molekylær størrelse og masse:
* klor (cl₂): Klormolekyler er diatomiske og har en højere molekylvægt end kryptonatomer. Dette fører til stærkere London -spredningskræfter.
* krypton (KR): Krypton er et enkelt atom med en lavere molekylvægt, hvilket resulterer i svagere London -spredningskræfter.
Kortfattet:
De stærkere London -spredningskræfter i klor på grund af dens større størrelse, højere polariserbarhed og diatomisk karakter fører til et højere kogepunkt sammenlignet med Krypton, der kun udviser svage London -spredningskræfter.
Selvom både klor og krypton er ikke -polære, resulterer forskellene i deres intermolekylære kræfter og molekylære egenskaber i et signifikant højere kogepunkt for klor.
Sidste artikelHvad er der i et atom af svovl?
Næste artikelHvad er forskudt fra brint, når du tilsætter et reaktivt metal?
 Varme artikler
Varme artikler
-
 Video:Hvorfor antarktiske fisk ikke fryser ihjelKredit:The American Chemical Society De notothenioidfisk, der bor i det Antarktiske Ocean, har udviklet en usædvanlig tilpasning til at leve i iskolde farvande. Deres blod indeholder frostvæskepr
Video:Hvorfor antarktiske fisk ikke fryser ihjelKredit:The American Chemical Society De notothenioidfisk, der bor i det Antarktiske Ocean, har udviklet en usædvanlig tilpasning til at leve i iskolde farvande. Deres blod indeholder frostvæskepr -
 Ny NMR-teknik tilbyder molekylært vindue til levende organismerProfessor Andre Simpson har udviklet en ny NMR-teknik, der kan få en højopløselig profil af, hvilke molekyler der er til stede inde i en levende organisme. Kredit:Ken Jones En ny teknik udviklet a
Ny NMR-teknik tilbyder molekylært vindue til levende organismerProfessor Andre Simpson har udviklet en ny NMR-teknik, der kan få en højopløselig profil af, hvilke molekyler der er til stede inde i en levende organisme. Kredit:Ken Jones En ny teknik udviklet a -
 Forskere udvikler en ikke-invasiv test for røgforurening i vinmarkerKredit:CC0 Public Domain Forskere fra universiteterne i Melbourne og Adelaide har afprøvet en ikke-invasiv model til påvisning af røgforurening i vinstokke, hjælpe landmænd med at sikre kvalitetsp
Forskere udvikler en ikke-invasiv test for røgforurening i vinmarkerKredit:CC0 Public Domain Forskere fra universiteterne i Melbourne og Adelaide har afprøvet en ikke-invasiv model til påvisning af røgforurening i vinstokke, hjælpe landmænd med at sikre kvalitetsp -
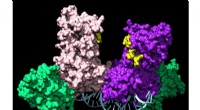 Udforsker grænserne for en ny form for kemoEt par DNMT3A-enzymer forbinder to hjælpeproteiner (grønne) for at danne et firedelt kompleks, der rejser langs DNA og tilføjer kemiske mærker, der fortæller en celle, hvilke gener den skal udtrykke.
Udforsker grænserne for en ny form for kemoEt par DNMT3A-enzymer forbinder to hjælpeproteiner (grønne) for at danne et firedelt kompleks, der rejser langs DNA og tilføjer kemiske mærker, der fortæller en celle, hvilke gener den skal udtrykke.
- Hvilken underskal er indeholdt i N 5 Electron Shell?
- Økologers værktøj vurderer planters sundhed fra oven
- Faldende snepakning over det vestlige USA kortlagt i finere skala
- Kan du bære formørkelsesglas over regelmæssige til at se solen sikkert?
- Brint blæser op:Fra videnskabeligt eksperiment til eksportindustri
- Hvorfor bliver planter lysegrønne


