Udforsker grænserne for en ny form for kemo
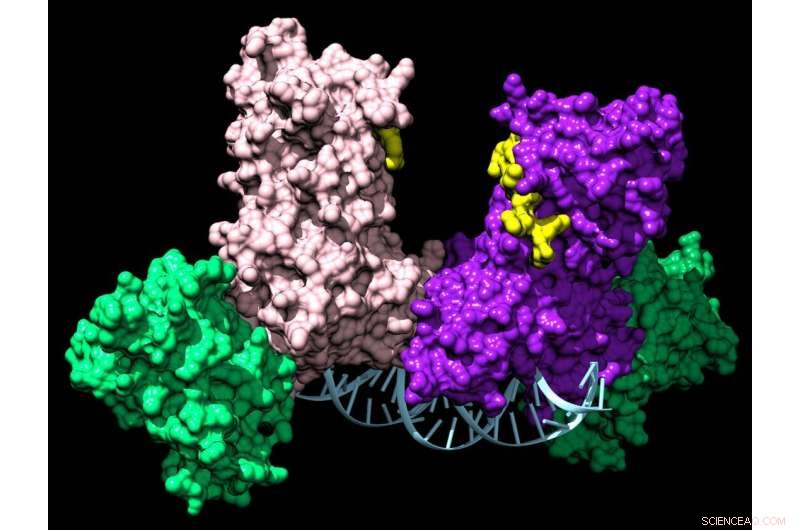
Et par DNMT3A-enzymer forbinder to hjælpeproteiner (grønne) for at danne et firedelt kompleks, der rejser langs DNA og tilføjer kemiske mærker, der fortæller en celle, hvilke gener den skal udtrykke. Kredit:Jonathan Sandoval et al.
Kemoterapi stinker. Behandlingerne har generelt forfærdelige bivirkninger, og det er ingen hemmelighed, at de involverede lægemidler ofte er giftige for patienten såvel som deres kræftsygdom. Tanken er, at da kræftformer vokser så hurtigt, vil kemoterapi dræbe sygdommen, før dens bivirkninger dræber patienten. Det er derfor, videnskabsmænd og læger konstant søger efter mere effektive terapier.
Et hold ledet af forskere ved UC Santa Barbara, og herunder samarbejdspartnere fra UC San Francisco og Baylor College of Medicine, har identificeret to forbindelser, der er mere potente og mindre toksiske end nuværende leukæmibehandlinger. Molekylerne virker på en anden måde end standard kræftbehandlinger og kan danne grundlag for en helt ny klasse af lægemidler. Desuden bruges forbindelserne allerede til behandling af andre sygdomme, hvilket drastisk reducerer mængden af bureaukrati involveret i at skræddersy dem mod leukæmi eller endda ordinere dem off-label. Resultaterne vises i Journal of Medicinal Chemistry .
"Vores arbejde med et enzym, der er muteret i leukæmipatienter, har ført til opdagelsen af en helt ny måde at regulere dette enzym på, såvel som nye molekyler, der er mere effektive og mindre giftige for menneskelige celler," sagde UC Santa Barbara Distinguished Professor Norbert Reich, undersøgelsens tilsvarende forfatter.
Epigenomet
Alle celler i din krop indeholder det samme DNA eller genom, men hver enkelt bruger en anden del af denne plan baseret på, hvilken type celle det er. Dette gør det muligt for forskellige celler at udføre deres specialiserede funktioner, mens de stadig bruger den samme instruktionsmanual; i det væsentlige bruger de bare forskellige dele af manualen. Epigenomet fortæller cellerne, hvordan de skal bruge disse instruktioner. For eksempel bestemmer kemiske markører, hvilke dele der bliver læst, hvilket dikterer en celles faktiske skæbne.
En celles epigenom kopieres og bevares af et enzym (en type protein) kaldet DNMT1. Dette enzym sikrer f.eks., at en delende levercelle bliver til to leverceller og ikke en hjernecelle.
Men selv hos voksne har nogle celler brug for at differentiere til forskellige slags celler, end de var før. For eksempel er knoglemarvsstamceller i stand til at danne alle de forskellige blodcelletyper, som ikke formerer sig af sig selv. Dette styres af et andet enzym, DNMT3A.
Dette er alt sammen godt og vel, indtil noget går galt med DNMT3A, hvilket får knoglemarv til at blive til unormale blodceller. Dette er en primær begivenhed, der fører til forskellige former for leukæmi, såvel som andre kræftformer.
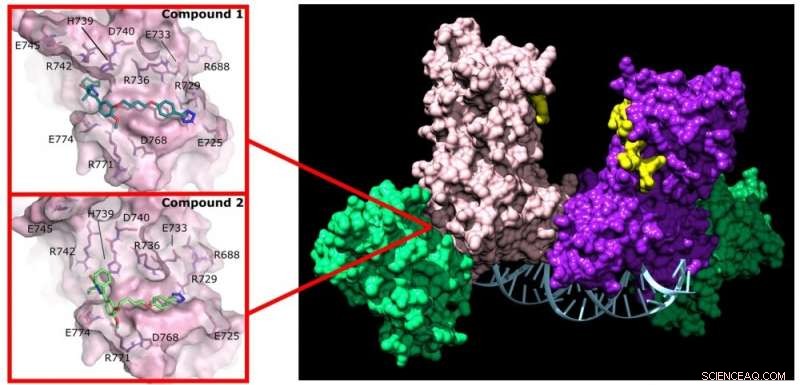
Pyrazolon (forbindelse 1) og pyridazin (forbindelse 2) forstyrrer aktiviteten af DNMT3A ved at binde sig til et ikke-aktivt sted på enzymet. Kredit:Jonathan Sandoval et al.
Giftige behandlinger
De fleste kræftlægemidler er designet til selektivt at dræbe kræftceller, mens de efterlader sunde celler alene. Men dette er ekstremt udfordrende, og derfor er så mange af dem ekstremt giftige. Nuværende leukæmibehandlinger, som Decitabine, binder til DNMT3A på en måde, der deaktiverer det, og derved bremser sygdommens udvikling. De gør dette ved at tilstoppe enzymets aktive sted (i det væsentlige dets forretningsende) for at forhindre det i at udføre sin funktion.
Desværre er DNMT3A's aktive sted stort set identisk med DNMT1's, så lægemidlet lukker ned for epigenetisk regulering i alle patientens 30 til 40 billioner celler. Dette fører til en af lægemiddelindustriens største flaskehalse:toksicitet uden for målet.
At tilstoppe et proteins aktive websted er en ligetil måde at tage det offline på. Det er derfor, det aktive websted ofte er det første sted, lægemiddeldesignere ser, når de designer nye lægemidler, forklarede Reich. Men for omkring otte år siden besluttede han sig for at undersøge forbindelser, der kunne binde sig til andre steder i et forsøg på at undgå effekter uden for målet.
Samarbejde
Da gruppen undersøgte DNMT3A, lagde de mærke til noget ejendommeligt. Mens de fleste af disse epigenetisk-relaterede enzymer virker alene, dannede DNMT3A altid komplekser, enten med sig selv eller med partnerproteiner. Disse komplekser kan involvere mere end 60 forskellige partnere, og interessant nok fungerer de som homing-enheder til at dirigere DNMT3A til at kontrollere bestemte gener.
Tidligt arbejde i Reich-laboratoriet, ledet af den tidligere kandidatstuderende Celeste Holz-Schietinger, viste, at forstyrrelse af komplekset gennem mutationer ikke forstyrrede dets evne til at tilføje kemiske markører til DNA'et. DNMT3A opførte sig dog anderledes, når den var alene eller i et simpelt par; det var ikke for at blive på DNA'et og markere det ene sted efter det andet, hvilket er afgørende for dets normale cellulære funktion.
Omtrent på samme tid, New England Journal of Medicine kørte et dybt dyk ned i de mutationer, der findes hos leukæmipatienter. Forfatterne af denne undersøgelse opdagede, at de hyppigste mutationer hos patienter med akut myeloid leukæmi er i DNMT3A-genet. Overraskende nok havde Holz-Schietinger studeret nøjagtig de samme mutationer. Holdet havde nu en direkte forbindelse mellem DNMT3A og de epigenetiske ændringer, der fører til akut myeloid leukæmi.
Opdagelse af en ny behandling
Reich og hans gruppe blev interesseret i at identificere lægemidler, der kunne interferere med dannelsen af DNMT3A-komplekser, der forekommer i kræftceller. De opnåede et kemisk bibliotek indeholdende 1.500 tidligere undersøgte lægemidler og identificerede to, der forstyrrer DNMT3A-interaktioner med partnerproteiner (protein-protein-hæmmere eller PPI'er).
Desuden binder disse to lægemidler sig ikke til proteinets aktive sted, så de påvirker ikke DNMT1 på arbejde i alle kroppens andre celler. "Denne selektivitet er præcis, hvad jeg håbede at opdage sammen med eleverne på dette projekt," sagde Reich.
Disse lægemidler er mere end blot et potentielt gennembrud i leukæmibehandling. De er en helt ny klasse af lægemidler:protein-proteinhæmmere, der målretter en del af enzymet væk fra dets aktive sted. "En allosterisk PPI er aldrig blevet lavet før, i det mindste ikke for et epigenetisk lægemiddelmål," sagde Reich. "Det gav mig virkelig et smil på læben, da vi fik resultatet."
Denne præstation er ingen ringe bedrift. "At udvikle små molekyler, der forstyrrer protein-protein-interaktioner, har vist sig at være udfordrende," bemærkede hovedforfatter Jonathan Sandoval fra UC San Francisco, en tidligere doktorand i Reichs laboratorium. "Dette er de første rapporterede hæmmere af DNMT3A, der forstyrrer protein-protein-interaktioner."
De to forbindelser, holdet identificerede, er allerede blevet brugt klinisk til andre sygdomme. Dette eliminerer en masse omkostninger, test og bureaukrati involveret i at udvikle dem til leukæmibehandlinger. Faktisk kunne onkologer ordinere disse lægemidler til patienter ude af mærket lige nu.
Bygger på succes
Der er dog stadig mere at forstå om denne nye tilgang. Holdet ønsker at lære mere om, hvordan protein-protein-hæmmere påvirker DNMT3A-komplekser i sunde knoglemarvsceller. Reich samarbejder med kemiprofessor Tom Pettus ved UC Santa Barbara og deres fælles ph.d.-studerende, Ivan Hernandez. "Vi foretager ændringer i stofferne for at se, om vi kan forbedre selektiviteten og styrken endnu mere," sagde Reich.
Der er også mere at lære om stoffernes langsigtede virkninger. Fordi forbindelserne virker direkte på enzymerne, ændrer de muligvis ikke de underliggende mutationer, der forårsager kræften. Denne advarsel påvirker, hvordan læger kan bruge disse stoffer. "En tilgang er, at en patient vil fortsætte med at modtage lave doser," sagde Reich. "Alternativt kan vores tilgang bruges sammen med andre behandlinger, måske for at bringe tumorbyrden ned til et punkt, hvor det er en mulighed at stoppe behandlingen."
Reich indrømmer også, at holdet endnu ikke har fundet ud af, hvilken effekt PPI'erne har på knoglemarvsdifferentiering på lang sigt. De er nysgerrige på, om stofferne kan fremkalde en eller anden form for cellulær hukommelse, der kan afbøde problemer på det epigenetiske eller genetiske niveau.
Når det er sagt, er Reich opmuntret af deres opdagelse. "Ved ikke at målrette mod DNMT3A's aktive side, er vi allerede ligaer ud over det aktuelt brugte lægemiddel, Decitabine, som absolut er cytotoksisk," sagde han og tilføjede, at denne type tilgang også kunne skræddersyes til andre kræftformer. + Udforsk yderligere
Forskere finder en overraskende sammenhæng mellem mitokondrielt DNA og øget risiko for åreforkalkning
 Varme artikler
Varme artikler
-
 Ny ultrahurtig metode til bestemmelse af antibiotikaresistensKlebsiella pneumoniae vokser i den mikrofluidiske chip afbildet i fasekontrast. Bakterierne er 0,003 mm lange og deler sig hvert 30. min. Kredit:Özden Baltekina, et al Forskere ved Uppsala Univer
Ny ultrahurtig metode til bestemmelse af antibiotikaresistensKlebsiella pneumoniae vokser i den mikrofluidiske chip afbildet i fasekontrast. Bakterierne er 0,003 mm lange og deler sig hvert 30. min. Kredit:Özden Baltekina, et al Forskere ved Uppsala Univer -
 Biomimetisk hydrogel med fotodynamisk antimikrobiel effektKredit:Wiley Infektioner er en frygtet trussel, der kan få fatale konsekvenser efter en operation, ved behandling af sår, og under vævsteknologi. Biomimetiske hydrogeler med indbyggede antimikrobi
Biomimetisk hydrogel med fotodynamisk antimikrobiel effektKredit:Wiley Infektioner er en frygtet trussel, der kan få fatale konsekvenser efter en operation, ved behandling af sår, og under vævsteknologi. Biomimetiske hydrogeler med indbyggede antimikrobi -
 Den grundlæggende kemi bag elektrokatalytisk vandspaltningOxygen evolution reaktion. Kredit:Matthias Frei, ETH Zürich Overgang til en bæredygtig energiøkonomi kræver elektrokatalytiske metoder til at konvertere elektrisk energi til kemisk energi og råsto
Den grundlæggende kemi bag elektrokatalytisk vandspaltningOxygen evolution reaktion. Kredit:Matthias Frei, ETH Zürich Overgang til en bæredygtig energiøkonomi kræver elektrokatalytiske metoder til at konvertere elektrisk energi til kemisk energi og råsto -
 Fordobling af effektiviteten af organisk elektronikDobbeltdoping kan forbedre lyshøstningseffektiviteten af fleksible organiske solceller (venstre), koblingshastigheden for elektronisk papir (i midten) og effekttætheden af piezoelektriske tekstile
Fordobling af effektiviteten af organisk elektronikDobbeltdoping kan forbedre lyshøstningseffektiviteten af fleksible organiske solceller (venstre), koblingshastigheden for elektronisk papir (i midten) og effekttætheden af piezoelektriske tekstile
- Forskerhold bestemmer, hvordan elektronspin interagerer med krystalgitter i nikkeloxid
- Papirtynd e-skin reagerer på berøring ved at lyse op
- Hvordan kan genbrug påvirke et samfund?
- Britisk by, hvor romerne badede, straffer forurenende biler
- Lav er ved at tabe for løbeild, år efter at flammerne er slukket
- Pressede tilstande af lys kan forbedre feedbackkøling betydeligt


