Hvad er reaktionen af jern og magnesiumsulfat?
reaktionen
Den teoretiske reaktion er:
Fe (S) + MGSO₄ (AQ) → FESO₄ (AQ) + MG (S)
Denne reaktion repræsenterer jern (Fe), der forskyder magnesium (Mg) fra magnesiumsulfat (MGSO₄) til dannelse af jern (II) sulfat (FESO₄).
hvorfor det ikke sker let
* reaktivitetsserie: Jern er mindre reaktivt end magnesium. Dette betyder, at magnesium er mere tilbøjelig til at holde fast i sine sulfationer end jern er at fortrænge dem.
* Standardbetingelser: Under standardbetingelser er det usandsynligt, at denne reaktion forekommer. Jern er ikke et stærkt nok reduktionsmiddel til at fortrænge magnesium fra dets sulfatsalt.
betingelser for reaktion
* Elektrokemisk celle: For at tvinge denne reaktion kan du oprette en elektrokemisk celle, hvor jern fungerer som anode og magnesiumsulfat er elektrolytten. På anvendelse af en ekstern spænding ville drive reaktionen.
* Høje temperaturer: Ved meget høje temperaturer kan reaktionen blive mulig, men den er meget usandsynlig under typiske laboratorieforhold.
Kortfattet
Mens reaktionen teoretisk er mulig, er det ikke en spontan proces under normale omstændigheder. Du bliver nødt til at levere energi (som i en elektrokemisk celle) for at tvinge den til at forekomme.
Sidste artikelHvad er tilstanden af stofsklor?
Næste artikelEr dihydrogen -phosphatsyre eller base?
 Varme artikler
Varme artikler
-
 Tilbereder et ledende alternativ til kobber med aluminiumAluminium er kun en tredjedel af prisen og vægten af kobber, men det er kun omkring 60% som ledende. Aluminiums relativt lave ledningsevne kan være en begrænsning i nogle virkelige applikationer. Kr
Tilbereder et ledende alternativ til kobber med aluminiumAluminium er kun en tredjedel af prisen og vægten af kobber, men det er kun omkring 60% som ledende. Aluminiums relativt lave ledningsevne kan være en begrænsning i nogle virkelige applikationer. Kr -
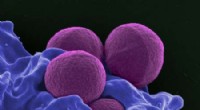 Ikke flere superbugs? Ahornsirup ekstrakt forbedrer den antibiotisk virkningEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Antibiotika redder liv hver dag, men der er en ulempe ved deres allestedsnærværende. Høje
Ikke flere superbugs? Ahornsirup ekstrakt forbedrer den antibiotisk virkningEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Antibiotika redder liv hver dag, men der er en ulempe ved deres allestedsnærværende. Høje -
 Nye fotokatalysatorer kan udføre solcelledrevet omdannelse af kuldioxid til brændstofVedtagelse af den fotokatalytiske omdannelse af CO2 til brændstof i højemissionsanlæg ville være yderst gavnlig for både miljøet og økonomien. Kredit:Shutterstock Forskere ved Daegu Gyeongbuk Inst
Nye fotokatalysatorer kan udføre solcelledrevet omdannelse af kuldioxid til brændstofVedtagelse af den fotokatalytiske omdannelse af CO2 til brændstof i højemissionsanlæg ville være yderst gavnlig for både miljøet og økonomien. Kredit:Shutterstock Forskere ved Daegu Gyeongbuk Inst -
 Cellemembran som materiale til knogledannelseForståelse af biologiske fænomener fra en tværfaglig tilgang muliggør udvikling og optimering af bioinspirerede materialer. Kredit:Bioinspired Engineering Udbruddet af celler, der danner brusk, er
Cellemembran som materiale til knogledannelseForståelse af biologiske fænomener fra en tværfaglig tilgang muliggør udvikling og optimering af bioinspirerede materialer. Kredit:Bioinspired Engineering Udbruddet af celler, der danner brusk, er
- Video:Copernicus Sentinel-6 Michael Freilich forbereder lanceringen
- Opsamling og lagring af kulstof i jord:Er det ægte dåseskalering?
- Klimapåvirkede ændringer i blomstring, frugt påvirker også fuglens overflod, aktiviteter
- Den forvirrende forbindelse mellem stjernedannelse og radioemission i galakser
- Sådan virker droneangreb
- Selv- og røntgeninduceret krystallisering af supramolekylære filamenter


