Selv- og røntgeninduceret krystallisering af supramolekylære filamenter
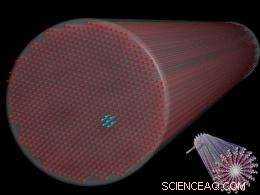
Fig. 1. En tegning, der viser et bundt af peptidfilamenter med en diameter på 10 nanometer, placeret i et sekskantet array. Lignende fænomener kan forekomme naturligt i cytoskeletoner i celler, øjets hornhinde, og andre biologiske områder. Indsats (nederst til højre) viser den molekylære struktur af individuelle filamenter. (Billede med tilladelse fra S.I. Stupp.)
(PhysOrg.com) - Eksperimenter kan nogle gange føre til opdagelse af helt uventede fænomener. Sådan er det med den bemærkelsesværdige adfærd, der udvises af peptid-nanostrukturer (i form af supramolekylære filamenter) observeret under eksperimenter udført af forskere fra Northwestern University ved beamline 5-ID fra DuPont-Northwestern-Dow Collaborative Access Team (DND-CAT) Synchrotron Research Center ved US Department of Energy's Advanced Photon Source (APS) ved Argonne National Laboratory.
Ifølge professor Samuel Stupp, hovedforfatter af undersøgelsen, der for nylig blev offentliggjort i Videnskab , mens han ”forsøgte at belyse den hierarkiske organisering af peptid -nanostrukturer”, opdagede hans team, at når det blev spredt i vand, disse filamentære nanostrukturer kunne organisere sig i sekskantpakkede bundter. Forskerne blev overraskede over at opdage, at ved tilstrækkeligt høje koncentrationer i opløsning, filamenterne kunne spontant samle sig til krystallinske strukturer (de sekskant-pakkede bundter). Endnu mere overraskende var konstateringen af, at røntgenstrålerne, der bruges til at sonde nanostrukturerne, også undertiden udløste filamentkrystallisering. Dette arbejde kan påvirke vores forståelse af nanostrukturer i biologiske systemer og vores evne til at kontrollere strukturen af materialer.
Filamenterne, der blev brugt til denne forskning, havde diametre på omkring 10 nanometer og længder i størrelsesordenen titalls mikrometer. Filamenterne blev afledt af et syntetisk molekyle indeholdende en kort peptidsekvens. Peptider er forbindelser, der indeholder to eller flere aminosyrer. Her, peptidsekvensen bestod af seks alaninaminosyremolekyler bundet til tre glutaminsyremolekyler - forkortet Ala 6 Glu 3 - som igen blev podet til et alkylmolekyle. De resulterende "supramolekyler" samles i vand for at danne filamenterne.
En række eksperimenter blev designet til at afsløre arrangementet af filamenterne dispergeret i vand. Forskellige vandige koncentrationer af filamenterne blev anbragt inde i bittesmå 2 mm-diameter kvarts kapillærer og undersøgt under anvendelse af lille-vinkel røntgenstråling (SAXS) ved DND-CAT beamline. Koncentrationerne varierede fra 0,5 til 5 vægtprocent. SAXS -data afslørede, at alle koncentrationer af filamenter aggregeret i bundter, der udviser en sekskantet pakning (se fig. 1). Organisering af filamenterne i sekskantpakkede bundter (dvs. krystallisering) er ganske bemærkelsesværdig. Men endnu mere bemærkelsesværdig var observationen, at den højere koncentration af filamenter (2 og 5 vægtprocent) spontant krystalliserede, mens opløsningerne med lavere koncentration (0,5 og 1 vægtprocent) kun krystalliserede gennem røntgeneksponering.
Ifølge Prof. Stupp, krystallisation af filamenterne, enten ved selvsamling eller ved røntgeneksponering, udgør fænomener, som “vi ikke har set før” i andre supramolekylære systemer. Stupp bemærkede også, at "ved at udføre eksperimenterne ved APS -synkrotronen, vi var overraskede over at opdage, at røntgenstråler kunne fremme krystallisering. ”
Et fascinerende træk ved den røntgeninducerede krystallisering var processens reversibilitet, som faktisk var synlig. Ved hjælp af 1 vægtprocent opløsning, en kumulativ 200 sekunders røntgenbestråling gjorde den oprindeligt transparente opløsning uigennemsigtig, angiver krystallisering. Efter røntgenophør, opløsningens uigennemsigtighed faldt langsomt, indtil den var klar igen inden for cirka 40 minutter, angiver en tilbagevenden til uorden. Et opfølgende SAXS-eksperiment udsatte opløsningen for et antal 4-sekunders røntgenstråler. De eksperimentelle data viste, at de oprindeligt uordnede filamenter (afsløret ved den første 4-sekunders eksponering) gradvist undergik en ændring af sekskantordnede bundter af filamenter som registreret under de sidste røntgeneksponeringer. Da forsøget blev gentaget to timer senere, SAXS -data afslørede, at filamenterne igen var uordnede - den krystallinske struktur var forsvundet.
Forskerne overvejede, om fremmede faktorer kunne have bidraget til filamentbestilling. Intense røntgenstråler kan skabe nye kemiske forbindelser i en opløsning på grund af ionisering, samt producere subtil opvarmning. Imidlertid, efterfølgende test af filamentopløsningerne viste, at hverken uønskede kemiske arter, heller ikke termiske effekter, havde spillet en rolle i enten de spontane eller røntgenudløste krystalliseringer.
Med hensyn til den grundlæggende mekanisme, der er ansvarlig for krystallisation, forskerne forestiller sig, at den langsigtede stabilitet af de krystallinske domæner er en balance mellem to modsatrettede spændinger:elektriske ladninger, der findes på filamenterne (enten native eller induceret af røntgenbestråling) har en tendens til at skubbe filamentbundter fra hinanden, mens indfangning af filamenter i det større netværk fører til en indadgående mekanisk komprimering.
Eksperimentelle data afslørede, at efterhånden som filamentkoncentrationen voksede, antallet af filamenter i bundterne steg også indtil en kritisk koncentration af filamenter resulterede i deres spontane sekskantede arrangement i bundterne (dvs. krystallisering). På den anden side, lavere filamentkoncentrationer - ude af stand til spontant at krystallisere - kunne kun gøre det, når røntgenstråler øgede ladningstætheden på filamenternes overflader, derved ændrer balancen mellem filamentkræfter til fordel for krystallisering.
Den samme mekanisme, der skabte deres menneskeskabte krystallinske filamentære netværk, kan meget vel virke i biologiske celler, ledende professor Stupp til at konstatere, at “denne forskning kunne hjælpe os med at forstå organisationen af nanostrukturer i biologiske systemer, og kan også have applikationer til at styre strukturen af materialer. ”
Sidste artikelNanovaccine vender type 1 -diabetes hos mus
Næste artikelMed støtte, grafen stadig en overlegen termisk leder
 Varme artikler
Varme artikler
-
 Nanomedicin på vej gennem kroppen(Phys.org) -- Hvilke veje tager nanomedicin efter at de er blevet slugt? Forskere finder en recirkulationsvej for polymere miceller ved hjælp af multimodal ikke-lineær optisk mikroskopi. Fremskridt i
Nanomedicin på vej gennem kroppen(Phys.org) -- Hvilke veje tager nanomedicin efter at de er blevet slugt? Forskere finder en recirkulationsvej for polymere miceller ved hjælp af multimodal ikke-lineær optisk mikroskopi. Fremskridt i -
 Teknik til at syntetisere monolag filmFigur:(øverst) Fotos, der viser spin-coating-indstillinger, der bruges til at belægge en substratoverflade med en kolloid suspension af titaniumoxid-nanoark. (Bund) Skematisk diagram, der illustrerer
Teknik til at syntetisere monolag filmFigur:(øverst) Fotos, der viser spin-coating-indstillinger, der bruges til at belægge en substratoverflade med en kolloid suspension af titaniumoxid-nanoark. (Bund) Skematisk diagram, der illustrerer -
 Guld rammer sin guldalder som et højteknologisk materialeNanoporøst guld. Kredit:American Chemical Society Guld er ikke længere kun til bryllupsbånd. På trods af sit ry som inert materiale, nanostruktureret guld er en meget lovende kandidat som katalys
Guld rammer sin guldalder som et højteknologisk materialeNanoporøst guld. Kredit:American Chemical Society Guld er ikke længere kun til bryllupsbånd. På trods af sit ry som inert materiale, nanostruktureret guld er en meget lovende kandidat som katalys -
 Forskere kombinerer grafen og kobber i håb om at krympe elektronikPradyumna Goli, venstre, og Alexander Balandin i Balandins Nano-Device Laboratory. (Phys.org)-Forskere har opdaget, at oprettelse af en sandwich med grafen-kobber-grafen stærkt forbedrer kobberens
Forskere kombinerer grafen og kobber i håb om at krympe elektronikPradyumna Goli, venstre, og Alexander Balandin i Balandins Nano-Device Laboratory. (Phys.org)-Forskere har opdaget, at oprettelse af en sandwich med grafen-kobber-grafen stærkt forbedrer kobberens
- Slap af på din opsparing? Kognitiv bias kan være skylden
- Effekter af Hydrogen Bomb
- OCR4all:Moderne værktøj til gamle tekster
- Billede:Canadian Arctic Archipelago
- Vilde dyr blev rutinemæssigt fanget og handlet i det gamle Mesoamerika
- Parlamentsmedlemmer bør overveje online-afstemning under COVID-19-pandemien, siger forsker


