Hvad sker der, når du opvarmer vandfri kobbersulfat?
1. Indledende dehydrering:
* Anhydrus kobbersulfat er et hvidt pulver.
* Ved opvarmning absorberer det vand fra luften og omdannes til hydreret kobbersulfat (cuso₄ · 5H₂o), som er blå.
2. Dehydrering og farveændring:
* Når du fortsætter med at opvarme, køres vandmolekylerne bundet til kobbersulfatet, hvilket efterlader vandfri kobbersulfat igen.
* Denne dehydreringsproces får det blå hydratiserede kobbersulfat til at blive hvidt igen.
3. Termisk nedbrydning:
* Hvis du opvarmer det vandfri kobbersulfat yderligere, gennemgår det termisk nedbrydning.
* Kobbersulfatet opdeles i kobber (II) oxid (CuO), svovltrioxid (SO₃) og iltgas (O₂).
* Reaktionen kan repræsenteres som:
`` `
2CUSO₄ (S) → 2CUO (S) + 2SO₃ (G) + O₂ (G)
`` `
Nøgleobservationer:
* farveændring: Farven skifter fra blå til hvid og derefter tilbage til hvidt.
* Gasudvikling: Der vil være en mærkbar frigivelse af svovltrioxidgas, som kan identificeres ved dens skarp lugt.
* Rester: En sort rest af kobber (II) oxid forbliver efter nedbrydningen.
Generelt viser opvarmningen af vandfri kobbersulfat den reversible karakter af hydratisering og den termiske nedbrydning af en forbindelse.
Sidste artikelEr smeltende kobber en eksoterme proces?
Næste artikelHvad sker der, når svovl reagerer med kalium?
 Varme artikler
Varme artikler
-
 Gamle enzymer katalysatorer for nye opdagelser(L-R) Elizabeth Gillam og Jong-Min (Joseph) Baek ser på P450 enzymspektre på et specialiseret spektrofotometer, vurdere om proteinet er intakt eller inaktivt. Kredit:University of Queensland Forsk
Gamle enzymer katalysatorer for nye opdagelser(L-R) Elizabeth Gillam og Jong-Min (Joseph) Baek ser på P450 enzymspektre på et specialiseret spektrofotometer, vurdere om proteinet er intakt eller inaktivt. Kredit:University of Queensland Forsk -
 Ny, meget stabil katalysator kan hjælpe med at omdanne vand til brændstofPostdoktor Jaemin Kim, professor i kemisk og biomolekylær teknik Hong Yang og kandidatstuderende Pei-Chieh (Jack) Shih er en del af et team, der udviklede et nyt materiale, der hjælper med at spalte v
Ny, meget stabil katalysator kan hjælpe med at omdanne vand til brændstofPostdoktor Jaemin Kim, professor i kemisk og biomolekylær teknik Hong Yang og kandidatstuderende Pei-Chieh (Jack) Shih er en del af et team, der udviklede et nyt materiale, der hjælper med at spalte v -
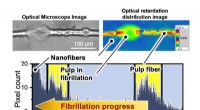 Bestemmelse af slankning af træmasseFigur 1. Pixelopløst distributionsanalyse viser, at den optiske retardering falder med stigende grad af papirmasseflimmer. Kredit:Osaka University Forskere fra Institute of Scientific and Industri
Bestemmelse af slankning af træmasseFigur 1. Pixelopløst distributionsanalyse viser, at den optiske retardering falder med stigende grad af papirmasseflimmer. Kredit:Osaka University Forskere fra Institute of Scientific and Industri -
 Softwareprogrammet Allchemy identificerer præbiotisk syntese af biokemiske forbindelser fra urpræk…Et team af forskere, der arbejder i Institut for Organisk Kemis laboratorium på det polske videnskabsakademi, har udviklet et softwareprodukt til at hjælpe med at opdage de kemiske processer, der ført
Softwareprogrammet Allchemy identificerer præbiotisk syntese af biokemiske forbindelser fra urpræk…Et team af forskere, der arbejder i Institut for Organisk Kemis laboratorium på det polske videnskabsakademi, har udviklet et softwareprodukt til at hjælpe med at opdage de kemiske processer, der ført
- Forskere genererer tomater med forbedrede antioxidantegenskaber ved genteknologi
- Nanostruktureret flad linse bruger maskinlæring til at se mere klart, mens der bruges mindre strøm…
- Hvis vi ved, at det samlede beløb i et system er 30 Joules og Poteial Energy 20jolueshvad ke?
- Utrolige nyheder? Læs det igen, og du tror måske, det er sandt
- Sådan fodrer Wild Equirrels
- Lipids fysiske og kemiske egenskaber


