Hvad sker der, når svovl reagerer med kalium?
8k + S₈ → 8K₂s
Her er en sammenbrud af, hvad der sker:
* kalium (k) er et meget reaktivt alkalimetal. Det mister let sit yderste elektron for at danne en positiv ion (K⁺).
* svovl (r) er en ikke -metal, der let får elektroner til at danne en negativ ion (s²⁻).
* Når kalium og svovl kommer i kontakt, mister kaliumatomerne deres elektroner til svovlatomerne. Denne overførsel af elektroner resulterer i dannelsen af kaliumkationer (K⁺) og sulfidanioner (S²⁻).
* Disse ioner kombineres derefter for at danne en ionisk forbindelse, kaliumsulfid (K₂S).
Reaktionen er så kraftig, at den kan producere en flamme og endda en eksplosion, hvis reaktanterne ikke er omhyggeligt kontrolleret. Derfor bør denne reaktion kun udføres af uddannede fagfolk i laboratorieindstillinger med passende sikkerhedsforholdsregler.
Sikkerhedshensyn:
* Bland aldrig kalium og svovl uden korrekt sikkerhedsudstyr og træning.
* Denne reaktion genererer varme, så bær passende brandbestandigt tøj og arbejde i et godt ventileret område.
* Brug små mængder reaktanter og håndter dem med forsigtighed.
* har altid et brandslukker og førstehjælpskit let tilgængeligt.
Bemærk: Kaliumsulfid er et hvidt fast stof, der er opløseligt i vand. Det bruges i forskellige anvendelser, herunder produktion af andre svovlforbindelser og syntesen af organiske forbindelser.
Sidste artikelHvad sker der, når du opvarmer vandfri kobbersulfat?
Næste artikelHvad sker der, når du blander svovl og kulstof sammen?
 Varme artikler
Varme artikler
-
 Molekylær modelleringskit i mikrometerstørrelse viser ægte kemiske reaktionerEn kunstners indtryk af nogle molekyler, der kan laves og studeres ved hjælp af det nye modelleringssæt. Kredit:Laura Quarto Molekyler er så små, at vi ikke engang kan se dem med almindelige mikro
Molekylær modelleringskit i mikrometerstørrelse viser ægte kemiske reaktionerEn kunstners indtryk af nogle molekyler, der kan laves og studeres ved hjælp af det nye modelleringssæt. Kredit:Laura Quarto Molekyler er så små, at vi ikke engang kan se dem med almindelige mikro -
 Team udvikler ny halvlederbehandlingsteknologiEn konstruktion designet på en sådan måde, at kun grønt lys må passere. Kredit:TU Wien Ekstremt fine porøse strukturer med bittesmå huller, ligner en slags svamp på nanoniveau, kan genereres i hal
Team udvikler ny halvlederbehandlingsteknologiEn konstruktion designet på en sådan måde, at kun grønt lys må passere. Kredit:TU Wien Ekstremt fine porøse strukturer med bittesmå huller, ligner en slags svamp på nanoniveau, kan genereres i hal -
 Undersøgelse afslører dynamisk adfærd af Cu-N-C enkeltatom-katalysator i elektrokatalyseKredit:CC0 Public Domain Atomisk dispergerede M-N-C (M refererer til overgangsmetaller) materialer betragtes som de mest lovende alternativer til de Pt-baserede ædelmetalkatalysatorer til elektrok
Undersøgelse afslører dynamisk adfærd af Cu-N-C enkeltatom-katalysator i elektrokatalyseKredit:CC0 Public Domain Atomisk dispergerede M-N-C (M refererer til overgangsmetaller) materialer betragtes som de mest lovende alternativer til de Pt-baserede ædelmetalkatalysatorer til elektrok -
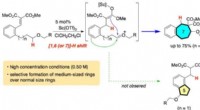 Forskere udvikler metode til at forbedre skelettet af almindelige kemikalierForskere i Japan udviklede en ny metode til at producere mere komplicerede og mellemstore (syv- og otte-leddede) carbocycles. Kredit:Keiji Mori, TUAT Ethvert kemikalie, fra det enkleste til det me
Forskere udvikler metode til at forbedre skelettet af almindelige kemikalierForskere i Japan udviklede en ny metode til at producere mere komplicerede og mellemstore (syv- og otte-leddede) carbocycles. Kredit:Keiji Mori, TUAT Ethvert kemikalie, fra det enkleste til det me
- Hvad er glansen af polonium?
- Fordele og ulemper ved polymerkompositter
- Hvor i skorpen formede kul?
- Hvad er de vigtigste træk ved den dominerende halvkugle?
- Astronomer opdager en usædvanlig nuklear transient
- Nedbrydning af Beowulf:Statistisk teknik finder bevis på, at gammelengelsk digt havde en enkelt for…


