Hvorfor har klor eller silicium et højere smeltepunkt?
* binding: Silicium danner en kæmpe kovalent netværksstruktur, mens klor findes som et simpelt diatomisk molekyle (CL2).
* Giant Covalent Network: I silicium er hvert siliciumatom kovalent bundet til fire andre siliciumatomer, hvilket skaber et kontinuerligt tredimensionelt netværk. Dette stærke netværk kræver en masse energi til at bryde, hvilket resulterer i et højt smeltepunkt.
* diatomiske molekyler: Klormolekyler holdes sammen af relativt svage van der Waals -styrker. Disse kræfter overvindes let med en lille mængde energi, hvilket fører til et lavt smeltepunkt.
* atomstørrelse og elektronegativitet: Siliciumatomer er større og har en lavere elektronegativitet end kloratomer.
* Større størrelse: Større atomer har generelt svagere interatomiske kræfter. Imidlertid opvejer den stærke kovalente binding i Silicons netværksstruktur denne effekt.
* lavere elektronegativitet: Silicons lavere elektronegativitet resulterer i mindre polariserede bindinger, hvilket fører til svagere intermolekylære kræfter. Denne faktor er mindre signifikant sammenlignet med de stærke kovalente bindinger i Silicons netværk.
Kortfattet:
Silicons gigantiske kovalente netværksstruktur med stærke kovalente bindinger kræver markant mere energi til at bryde end de svage van der Waals -kræfter, der holder klormolekyler sammen. Denne forskel i binding forklarer det meget højere smeltepunkt for silicium.
Sidste artikelHvad er ladningen af to ioner fluor F2?
Næste artikelHvilket stof har højere smeltepunkt siliciumdioxid eller methanol?
 Varme artikler
Varme artikler
-
 Forskere finder en måde at skrælle slimede biofilm som gamle klistermærkerKredit:Princeton University Slimet, svært at rengøre bakteriemåtter kaldet biofilm forårsager problemer lige fra medicinske infektioner til tilstoppede afløb og tilsmudset industriudstyr. Nu, fors
Forskere finder en måde at skrælle slimede biofilm som gamle klistermærkerKredit:Princeton University Slimet, svært at rengøre bakteriemåtter kaldet biofilm forårsager problemer lige fra medicinske infektioner til tilstoppede afløb og tilsmudset industriudstyr. Nu, fors -
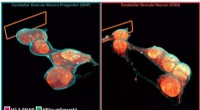 Mikroskopiteknik afslører cellers 3-D ultrastruktur i nye detaljerInde i en celle, tentakler vesikler shuttle last til sortering. DNA omarrangeres i kernen, efterhånden som stamceller differentieres til neuroner. Naboneuroner klamrer sig til hinanden gennem en web-l
Mikroskopiteknik afslører cellers 3-D ultrastruktur i nye detaljerInde i en celle, tentakler vesikler shuttle last til sortering. DNA omarrangeres i kernen, efterhånden som stamceller differentieres til neuroner. Naboneuroner klamrer sig til hinanden gennem en web-l -
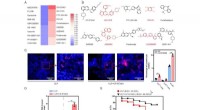 PDGFR-kinasehæmmer fundet at beskytte mod septisk død via regulering af BTLAA, Heatmap, der afbilder virkningen af lægemiddelbiblioteksinhibitorer på ekspressionsniveauet af BTLA i RAW264.7-celler ved in-celle western blotting. De 10 bedste lægemidler, der hæmmer (venstre)
PDGFR-kinasehæmmer fundet at beskytte mod septisk død via regulering af BTLAA, Heatmap, der afbilder virkningen af lægemiddelbiblioteksinhibitorer på ekspressionsniveauet af BTLA i RAW264.7-celler ved in-celle western blotting. De 10 bedste lægemidler, der hæmmer (venstre) -
 Ny katalysator til fremstilling af brændstof fra skifergasSTM-billeddannelse af reaktionsmellemprodukter på Cu(111)- og Pt/Cu SAA-overflader. Kredit:Sykes Metan i skifergas kan omdannes til kulbrintebrændstoffer ved hjælp af en innovativ platin- og kobbe
Ny katalysator til fremstilling af brændstof fra skifergasSTM-billeddannelse af reaktionsmellemprodukter på Cu(111)- og Pt/Cu SAA-overflader. Kredit:Sykes Metan i skifergas kan omdannes til kulbrintebrændstoffer ved hjælp af en innovativ platin- og kobbe
- Hvordan forårsager hældningen af aksen og bevægelse omkring solen sæsoner?
- Hvad er en vittighed for carbonhydrid?
- Er det sandt, at hvis en indkommende bølge og reflekteret har en høj frekvens, kombineres de for a…
- Et skridt mod personlig, automatiserede smarte hjem
- Manipulering af cellemembraner ved hjælp af nanorør
- Hvad er det at udrydde den direkte kraft?


